규소 (2)
풍부한 ......
규소는 암석과 토양의 주된 성분으로 지구의 외각층을 구성하는 원소비율인 클라크수 25.7%를 차지하며 산소(49.5%) 다음으로 많은 원소이다. 규소는 산소와 결합하여 암석중에 규산화물, 규산염의 형태로 암석과 토양을 이루고 있다. 비교적 안정한 구조를 가지고 있으며 반응성이 낮은 편이지만 그 바탕위에서 서식하고 생활하는 동식물 등 생물과 인체에 미치는 영향은 적지 않을 것이다.
규조(珪藻
)류, 벼과 식물과 같은 일부 생물들은 생육에 규소화합물의 영향이 크지만 대다수는 그 역할이 어떤 것인지 알려진 바가 적다. 그러나 물에 용해된 미량의 가용규소가 동식물이나 인체에 적지 아니한 영향을 주고 있음에는 틀림없다. 비록 그것이 규소의 유기화합물 형태는 아니더라도 무기질의 규소화합물 분자가 생체 안에서 방사에너지의 전달 매개체로서 에너지 발산 특성이 생체에 주는 영향이 있음을 짐작하게 한다. 미량의 가용성 규소성분이 농작물 이나 인체에서 병해 또는 충해에 대한 저항력을 키워 준다는 연구자료들을 접할 수 있기 때문이다.
매우 한정된 초보적 내용이기는 하지만 규소 화합물의 개요를 인용하여 정리하여 본다.
2010.9.29.
오갑록
■ 규소(珪素, Silicon, Si)
ウィキペディア(Wikipedia)자료 인용
규소(Si, 珪素、硅素, Silicium, Silicon, 원자번호 14)는 지구상 주요 구성원소 중의 하나(클라크 수 2위; 25.7%)며 반도체 부품공업 등에서도 아주 중요한 분야이다. 상온.상압에서 안정적인 결정구조는 다이아몬드 형 구조. 비중은 2.33, 융점 1410 ℃ (1420 ℃), 비등점은 2600 ℃ (그밖에 2355 ℃, 3280 ℃라는 실험값도 있음). 다이아몬드 구조의 실리콘은 1.12 eV의 밴드갭 (실험값)을 가진 반도체이다. 이것은 비금속이지만, 압력을 가하면 β 주석(Sn) 구조(beta-tin 構造, 正方晶)로 구조상전이(構造 相転移)를 한다. 이 β 주석 구조의 실리콘은 금속이다. 주기율표에서 바로 위에 있는 원소가 탄소인데, 탄소처럼 상온 상압에서 안정 상(相)인 그라파이트(흑연) 구조가 실리콘에서는 안정적인 구조로 존재할 수 없다.
규소의 Silicon은 라틴어로 "부싯돌"을 의미하는 "silex" "silicis"에서 연유된 것이다.
지각 중에 대량 존재하는 광물의 구성성분으로서 중요하며, 규산염 광물로 큰 그룹을 형성하고 있다. 이것은 Si-O-Si 결합의 다양한 형태로서 광물에 포함되어 있다. 그러나 생물과의 관계는 그다지 깊지 않은 편이다. 알려진 것으로는 방산충(放散虫), 규조(珪藻), 양치식물, 벼과(稲科)식물 등에서 이산화규소의 형태로서 골격에 이용되는 정도이다. 영양소로서의 필요성은 별로 알려지지 않고 있다. 탄소와 규소와의 화학적인 유사성에서 공상과학(SF, Science Fiction) 등에서는 실리콘을 주요 구성물질로서 실리콘 생물을 제기하기도 한다.
밴드갭이 상온 부근에서 이용하기 적당한 크기라는 것과, 붕소나 인 등의 불순물을 소량 첨가함으로써, p 형 반도체, n 형 반도체 중 어느 하나가 되는 등 전자 공학적으로도 중요한 원소이다. 반도체 부품으로 이용하기 위해서는 고순도가 요구되고, 이에 따라 정제기술이 활발하게 연구되어왔다. 현재 실리콘은 99.9999999999999 % (15 Nine)에 까지 이르는 고순도에 이르는 수준이다. 또한, Si 기판은 물질의 미세구조를 측정하는 장치인 AFM(원자간력 현미경, Atomic Force Microscope)이나 STM(주사 터널링 현미경, 走査 顯微鏡, Scanning Tunneling Microscope)의 표준시료로서도 이용되고 있다.
□ 규소의 용도
. 실리콘 단결정 적외선 광학계
실리콘은 적외선 영역 (파장 2~6 μm)에서의 높은 투과율 특성 때문에, 렌즈나 유리창 등의 소재로서 사용된다. 파장 4 μm의 굴절률은 3.4255
. 반도체가장 중요한 용도로는 사염화규소나 트리클로로실란 으로부터 만들어지는 고순도 규소가 반도체를 만드는 데 이용되는 것을 들 수 있다. 또한 액정디스플레이의 TFT(박막(薄膜)트랜지스터, Thin Film Transistor)나 태양전지는 비정질 실리콘이나 다결정 실리콘이 사용된다. 砒化갈륨이나 질화갈륨 등의 화합물 반도체의 기판에 실리콘을 이용하면 큰 폭의 원가절감이 가능하므로 다양한 연구가 진행되고 있다.
. 규소 함유 합금
전기로의 제철 원료로서 철 1 톤 당 4 Kg 내외 정도의 실리콘이 첨가된다. 실리콘을 첨가하여 강철의 산소 제거제로서 이용된다. 그 외에 규소를 혼합한 강판 (규소 강판)은 와전류(Eddy Current)에 의한 손실이 줄어들기 때문에 변압기에 사용되고 있다. 알루미늄 산업분야에서도 규소 합금이 사용되고 있다. 또한 Lead less 황동에도 첨가된다. .
. 규소 함유 세라믹 장치
규소 산화물(실리카)을 원료로 한 유리는 창문 등에 이용되는 외에도 섬유상으로 만든 글라스울은 단열 및 흡음재로서도 이용된다. 지올라이트는 이온 교환기나 흡착제 또는 유기화학공업에서 촉매가 되기도 한다. 실리카겔은 매우 사용하기 쉬운 건조제로서 이용된다.
탄화규소는 내화재료나 저항체로 사용되기도 하고, 높은 모스 경도 (9.5)를 갖고 있기 때문에 연마제로 사용된다. 기타 규소 화합물로는 알루미노 규산염이 점토에 포함되어 도기나 시멘트 벽돌 등 세라믹이라는 재료의 주성분으로 되고 있으며, 칼슘 화합물을 제거하는 기능이 있어서 물의 정제에도 사용되고 있다.
. 규산염 규소수지
규산염은 다양한 형태로 지각에 존재하고 있는데, 천연에 존재하는 대다수의 규소 화합물이 이산화규소나 규산염이다. 공업적으로 널리 이용되는, 유리, 도자기 등 헤아릴 수 없을 만큼 다양하다. 석면은 섬유상 규산염 광물로서 내약품성이나 내화성이 좋아 이전에는 건축자재 등으로 널리 사용 되었으나, 인체에 미치는 영향이 문제가 되어 최근에는 사용량이 격감하고 있다.
. 유기성 실리콘유기 기(基)를 갖는 규소의 이차원 또는 삼차원 산화물을 우리는 보통 실리콘이라고 부른다. 이것은 우수한 내열성, 내화학성, 저독성과 같은 유용한 특성을 가지고 있다. 油状의 것들은 왁스, 열매체(熱媒体), 소포제(消泡剤) 등에 사용된다. 삼차원 실리콘은 고무 탄성을 보이기 때문에 고무 상(状)의 것은 호스나 튜브, 수지 상(状)의 것은 페인트나 절연재료, 접착제 등 다양한 용도로 이용된다.
□ 제법 및 정제공정
공업용 규소의 주원료는 이산화규소 (SiO2, 규석, 珪砂, 실리카)이다. 알루미늄과 마찬가지로 산화물에서 환원하려면 많은 전력이 소모되기 때문에 금속 실리콘 상태로 수입하는 것이 일반적이다. 전력이 싼 국가가 금속 실리콘의 공급원이 되기 때문에 지금까지는 중국, 브라질, 러시아, 남아프리카 공화국, 노르웨이 등이 주요 공급 국가였지만 최근에는 호주, 말레이시아, 베트남 등도 주목 받고 있다. 순도 높은 이산화규소의 세계 매장량은 풍부한 편이다.
. 정제공정
. 금속 그레이드 (MG) 실리콘실리콘 단량체는 탄소 전극을 이용한 아크 로(炉)에서 이산화규소를 환원하여 얻는다. 이 때 정제되는 실리콘의 순도는 99 % 정도다.
SiO2 + C → Si + CO2
SiO2 + 2C → Si + 2CO
. 고순도 폴리실리콘
순도를 높이기 위해서는 염소와 반응시켜 사염화 실리콘(가스화)을 만들고, 이것을 다시 증류하여 제품의 순도를 높인다.
Si + 2Cl2 → SiCl4
SiCl4 +2 H2 → Si + 4 HCl
. 반도체 그레이드 (SEG) 실리콘집적회로 등 반도체 소자로 사용되는 초고순도 실리콘 (순도 11 Nine 이상)은 위의 고순도 실리콘에서 다시 FZ (플로팅 존 법) 등의 존멜팅법(Zone melting 법)이나 쵸크랄스키 법(Czochralski法、Cz法) 방식 같은 단결정 성장법에 의한 증착공정을 거쳐서 제조된다. 존멜팅 법은 융해대(融解帯)에 불순물이 농축하는 과정을 반복하여 고순도의 실리콘을 얻는다. Cz 법에서는 편석(偏析, segregation, 용융합금이나 고용체합금의 응고 시 최초 응고부분과 최후 응고부분의 조성에 차이가 나는 것)을 이용하여 순도를 높이기 때문에 원료인 폴리실리콘 (다결정 규소)은 매우 순도가 높은 것이 요구된다. 반도체로 사용하기 위해서는 기본적으로 결정결함(転位)이 없는 단결정이 필요하므로 FZ 법이던 Cz 법이던 단결정을 회전시키면서 일단 가늘게 하며, 転位를 밖으로 몰아내는 단계에서 크리스탈 직경을 키워 원하는 치수의 결정을 생산한다. FZ 법은 대구경화(大口径化)에 적합하지 않으므로 산업용 실리콘 웨이퍼의 대부분은 Cz 법으로 제조되고 있다. 현재 제품화되는 실리콘 웨이퍼 지름은 직경 300 mm까지이다.
. 태양전지 그레이드 (SOG) 실리콘태양전지에는 SEG 그레이드 정도의 초고순도가 요구되지 않으므로 7 Nine 정도의 순도면 족하다. 따라서 상기의 단결정 실리콘 잉고트 단재(端材) 등을 원료로서 이용되어 왔지만, 수요 증가에 따라 태양전지 전용그레이드 (솔라 그레이드) 실리콘 생산법이 개발되고 있다. 단계는 위의 반도체 그레이드 정제공정을 단순화하는 방법 외에도 다음과 같은 방법이 사용된다. 반도체 그레이드에 비해 에너지 소모나 비용이 몇 분의 1 이하에 불과한 기술이 많다.
. 유동상로(流動床炉, FBR) 법 : 종결정(種結晶)을 기류(気流)로 말아가면서 표면에 실리콘을 석출시킨다.. 야금법 : 금속 그레이드 실리콘에서 야금학적 기법을 통해 직접 솔라 그레이드 실리콘을 제조한다.. 물유리화법 : 규석 (珪石, SiO2)을 물 유리화된 상태에서 고순도화 한 후 환원한다.. NEDO 용융정제법 : 금속 그레이드 실리콘을 전자빔이나 플라즈마로 용융시켜 특정 불순물을 제거한 다음 한 방향으로 응고(一方向 凝固) 시킨다.
솔라 그레이드 실리콘은 2006 년경에는 고순도 실리콘 시장의 약 절반을 차지하고 있으며, 앞으로도 그 비중이 확대될 것으로 전망되고 있다. 앞으로는 솔라 그레이드가 고순도 실리콘 생산량의 대부분을 차지하고, 반도체은급 특수품으로 될 것이라고 예측되고 있다. 또한 태양전지용 실리콘 원료는 2008 년까지 공급부족으로 높은 가격대를 형성하고 있었지만, 2009 년부터는 가격 하락이 예측되고 있다.
. 각종 규소 화합물
일산화 규소 (SiO)
이산화 규소 (SiO2) - 석영 등
규산
질화 실리콘 (Si3N4)
탄화 규소 (SiC)
규산염 (MgSiO3 등)
사염화 규소 (SiCl4) - 연막
실란 (SiH4)
실리콘
실리콘 수지
환상 실록산 (D3, D4 등)
유기 실리콘 화합물 -(-Si(CH3)3) 등이 있는 유기화합물. 보호기(保護基)나 탈리기(脱離基)로서 유기합성에 쓰임
□ 이산화규소 SiO2
이산화규소 (SiO2, 석영, 실리카(silica), 무수규산), 분자량 60.1 g/mol, 백색분말, 밀도 2.2 g/cm3, 물에서의 용해도 0.012 g/100 mL ( °C), 융점 1650 (±75) ℃, 비점 2230 ℃
. 성질공유결합의 결정(結晶)이며, 규소 원자를 중심으로 산소가 정사면체 구조로 무수히 연결된 구조를 하고 있다.이산화규소의 결정(結晶) 중 대표적인 것으로는 석영(石英 Quartz, 수정 水晶), 인규석(鱗珪石 Tridymite), Cristobalite, Coesite, Stishovite, 충격석영(衝撃石英) 등이 있다.
온도. 압력을 변화시킬 때의 실리카 광물 (SiO2)의 변화는 상온상압 하에서는 α 석영으로 안정하지만, 573도 에서는 β 석영으로 전이한다. 더욱 온도를 높이면 870도에서 트리디마이트 다시 크리스티바라이트로 되며 융해에 이르게 된다. 온도가 아닌 압력을 올려 가면, 500 도에서 800 도의 경우 3.5GPa에서 Coesite(1953년 합성), 10GPa에서 Stishovite (1961년 합성)로 전이되는 것으로 나타 났다.
규소 원자는 상당한 고압 에서는 6 개의 산소 원자가 배위한 팔면체 구조를 취할 수 있다. 1961 년 소련의 S.M.Stishov와 S.V.Popova는 1200 ℃, 160kbar의 조건에서 인공합성에 성공했다 Stishovite 이다. 이것은 운석이 지표에 충돌했을 때에도 발생한다. 예로서 바린쟈 운석 구멍에서 발견되고있다. 천이층 하부 맨틀 정도의 고압 조건에서 실리카는 Stishovite 구조를 취할 것으로 생각한다.
전구의 내측에 도료로서 칠하여 너무 밝아지지 않도록 하며, 무기(無機) 유리의 주성분이기도 하며, 타이어의 고무에 강화 충전제로서 실리카가 배합되기도 한다.
. 반응
SiO2 + 4 HF(gas) → SiF4 + 2H2O
SiO2 + 6 HF(aq) → H2SiF6 + 2H2O
SiO2 + 2 NaOH → Na2SiO3 + H2O
. 매장량
이산화규소(실리카)는 석영, 규사, 규석 등의 형태로 채광한다. 천연 석영자원 량에는 한계가 있으므로 산업용으로는 대신 인공석영이 사용된다. 규사나 규석 자원은 풍부하며 공업용 고순도 원료도 전세계에 널리 분포한다.
□ 규산염 Silicate
규산염(silicate)은 1 개 또는 몇 개의 규소 원자를 중심으로 전기 음성인 배위자(配位子, ligand)가 이것을 둘러싼 구조를 가진 음이온을 포함하는 화합물을 말한다. SiF6 2- 등의 화학물질이 포함되기도 하지만, 일반적으로 흔히 볼 수 있는 규산염은 산소를 리간드로 한다. 규산염의 음이온은 다른 양이온과 결합하여 전기적으로 중성적인 화합물을 형성한다.
실리카(이산화규소, SiO2)는 규산염의 일종으로 생각할 수도 있다. 이것은 규소 주위에 부(負)전하를 띠지 않기 때문에 추가의 양이온을 포함하지 않는 특별한 경우이다. 실리카는 석영, 또는 그 여러 가지 형태의 광물로서 자연계에 존재한다.
규산염의 대표적인 구조 모델이자 규산염 광물로 대표되는 대부분 규산염의 규소 원자는 4 개의 산소 원자에 의해 둘러싸인 사면체 구조를 취한다. 광물의 종류에 따라 이 사면체가 늘어서는 정도가 달라서, 단독(単独), 대(対), 클러스터, 고리(환상 環状), 사슬 모양(쇄상 鎖状), 두 가닥 쇄상, 층상, 3 차원 망사형 등 다양하다. 규산염 광물은 음이온 구조의 특성에 따라 분류된다.
산소 원자 주위의 공간이 적기 때문에 일반 압력 조건에서는 6 배위의 규산염은 거의 볼 수 없지만, Thaumasite 등에는 헥사히드록시케토 이온 (Si(OH)6 2 -)으로 포함되어 있기도 한다.
. 규산 이온4 배위 규산 이온 중의 규소 원자는 4 개의 산소원자에 의해 둘러싸인 사면체 구조를 취하고 이 사면체가 1 개에서 무한 개까지 늘어선 다양한 종류가 있다.
오르토규산 이온 (SiO4 4 -), 피로규산 이온 (Si2O7 6 -) 기타의 축합 규산 이온이 알려져 있다. 환상 규산 이온으로는 Si3O9 6 -와 Si6O18 12 - 이 알려져 있다. 그리고 아래와 같은 다양한 무한 폴리 이온이 존재한다.
1차원 쇄상 1차원 2중쇄상 2차원 시트상 3차원 망상
. 규산염 광물
. 광물학에서 규산염 광물은 그 음이온 부분의 구조에 따라 구분 됨
텍토규산염 광물은 알루미늄 등의 원자 가(価) 수가 작은 원자로서 규사가 대체되어, 전체로서 음전 하를 띠게 경우에만 양이온 종류를 포함한다. 이러한 치환은 다른 규산염에서도 생긴다.
일부 희귀광물에서는 결정 구조 중에 여러 종류의 음이온이 공존하고 있기도 하고, 위에 열거한 두 종류의 중간 구조를 가진 복잡한 음이온이 포함되기도 한다.
. 규산염 암석
지질학이나 천문학에서의 규산염은 암석 종류의 일종이며, 규산염 광물을 주성분으로 하는 것을 말한다. 화성암, 변성암, 퇴적암의 대부분이 여기에 포함된다. 지구의 맨틀과 지각은 주로 규산염으로 구성되어 있으며, 다른 지구형 행성에 대해서도 마찬가지이다.
지구에는 지각의 형성, 부분적인 용융, 결정화, 분할, 변성 작용, 풍화, 소성작용 등의 과정을 통해 다양한 규산염 광물이 발생 해 왔다. 지표 부근에서는 생물이 규산염 발생에 기여하기도 한다. 플랑크톤의 일종이다. 규조류는 규산염으로 구성된 피각을 만들어 낸다. 심해의 침강물은 주로 규조류의 피각으로부터 나온 것이다.
주요 광석의 명칭
. 네소 규산염 광물(독립사면체형) - [SiO
4
]
4 -
감람석
,
석류석
Nesosilicates (lone tetrahedron) olivine
. 소로 규산염 광물(복사면체형) - [Si
2
O
7
]
6 -
녹렴석
Sorosilicates (double tetrahedra) epidote
. 사이크로 규산염 광물(환상형) - [SinO3n]2n- 녹주석, 전기석
Cyclosilicates (rings) tourmaline group
. 이노 규산염 광물(단일 고리) - [SinO3n]2 n- 휘석
Inosilicates (single chain) pyroxene group . 이노 규산염 광물 (2개 고리) - [Si4nO11n]6 n- 각섬석
Inosilicates(double chain) amphibole group
. 필로 규산염 광물(층상형) - [Si2nO5n]2 n- 운모, 점토 광물
Phyllosilicates (sheets) micas and clays
. 텍토 규산염 광물(망상형) - [AlxSiyO2(x+y)] x- 석영, 장석, 비석
Tectosilicates (3D framework) quartz, feldspars, zeolites
. 바잘트 (Basalt) . 화산암의 일종인 현무암을 바잘트라고 함 . SiO2 45~52%(중량)의 반상조직(斑状組織) . 유색광물인 휘석, 감람석, 무색광물인 사장석이 포함됨 알카리 현무암인 금운모 등도 포함됨
. 규소의 클라크 수 (Clarke number)
. 미국, F.W.클라크에 의한, 지구 최외각층을 구성하는 원소의 구성 중량비율 %,
지구 전체 중량의 0.3%에 해당하는 이 부분을 형성하는 물질 중의 원소존재 비율.
. 최외각층이란 평균해수면 (해발고도 0) 인 지오이드면에서부터 지하 약 16km까지의 깊이에 이르는
지각의 암석권(岩石圈), 해수(海水)를 포함한 수권(水圈), 지구를 둘러싼 대기권을 포함한 부분임.
. 중량 93.06%의 암석권, 6.91%의 수권 및 0.03%의 기권(氣圈)으로 구성됨.
1 산소 49.5% 2 규소 25.7% 3 알루미늄 7.6% 4 철 4.7% 5 칼슘 3.4%
6 나트륨 2.6% 7 칼륨 2.4% 8 마그네슘 1.9% 9 수소 0.8% 10 티탄 0.5%
11 염소 0.2% 12 망간 0.1% 13 인 0.1% 14 탄소 0.1% 15 유황 0.1%
□ 맨틀(Mantle)
다음백과 인용
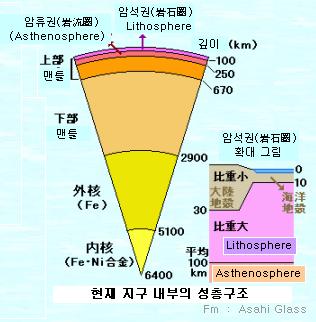
. 맨틀(mantle)은 지각 바로 아래에 있으면서 외핵을 둘러싸고 있는 두꺼운 암석층. 지표면으로부터 깊이 30-2,900Km의 범위에 분포. 지구 부피의 70% 가량을 차지
. 지각과 맨틀의 경계면은 발견자의 이름을 따 모호로비치치 불연속면이라고 부름. 보통은 줄여서 모호면이라고도 함. 맨틀의 최상부는 온도가 낮아 딱딱하게 굳어있는데, 이 부분과 지각을 합쳐서 암석권이라고 부름. 암석권에서는 주로 열전도에 의하여 열이 전달됨
. 맨틀과 지각은 크게 화학적 조성의 차이에 의해 구분됨. 지각은 사실상 맨틀의 최초 용융물질이 굳은 것이라고 생각할 수 있음. 맨틀 암석 . 감람석, 여러 종류의 휘석과 다른 고철질 광물로 되어있음 . 지각에 비하여 철과 마그네슘의 함량이 높고 규소와 알루미늄의 함량은 낮음. 맨틀의 온도 . 최상부에서 섭씨 100도 정도이지만 . 핵과의 경계면에서는 4000도에 육박함 . 이 온도면 암석이 용융상태가 되어야 하지만 높은 압력 때문에 고체상태임
. 연약권 . 암석권으로부터 250km 아래 까지를 연약권이라고 함 . 연약권에서는 주로 열 대류에 의하여 열이 전달됨. 열대류 . 지구의 표면과 외핵의 표면 사이에는 엄청난 온도차이가 있기 때문에 맨틀은 열대류를 통해 지표면으로 열을 발산하고 있음. 지구에서 맨틀의 대류는 유체역학적 관점으로 보았을 때 혼돈 과정임 또한 맨틀의 대류는 판운동의 원동력으로 여겨짐
. 점성 . 맨틀의 점성은 10^19 Pa.s에서 10^24 Pa.s 사이에서 변하는 것으로 생각됨 . 상부 맨틀의 상대적으로 낮은 점성 때문에 300km 이하 에서는 지진이 일어나지 않을 것으로 생각할 수 있지만 섭입대에서는 차가운 암석권의 물질이 깊은 곳으로 내려가고 있기 때문에 온도 구배가 낮아지고, 주위 맨틀의 강도가 높아져 670km 깊이에서도 지진이 일어날 수 있음
. 압력 . 맨틀 바닥 부분의 압력은 136 GPa (140만 기압) . 압력은 깊이와 함께 증가하지만 맨틀은 긴 시간척도에서는 유체처럼 변형될 수 있다고 봄
. 내핵과 외핵 . 내핵은 고체이고, 외핵은 액체 . 맨틀은 가소성 고체의 성질을 보이는 이유는 무엇일까? 그 답은 각 층의 녹는점에 달려있고, 녹는점은 다시 온도와 압력의 함수로 깊이에 따라 변해감 . 지구 표면에서는 규산염과 철-니켈 합금이 고체로 존재할 만큼의 낮은 온도 . 상부 맨틀은 온도가 높지만 상대적으로 압력이 낮아서 규산염 광물의 일부는 부분적으로 용융되어있고 상대적으로 점성이 낮은 반면에 하부 맨틀은 엄청난 압력을 받고 있기 때문에 상부 맨틀보다 점성이 높아짐 . 철-니켈 합금으로 되어있는 외핵은 높은 압력에도 불구하고 녹는점이 맨틀에 비해 낮기 때문에 액체로 존재할 수 있음 . 내핵은 지구 중심부의 굉장한 압력 때문에 고체로 존재
. 맨틀 암석의 채취 탐사 . 첫 탐사 (모콜 프로젝트)는 거듭되는 실패와 높은 비용 때문에 1966년에 중단됨 이때 판 깊이는 고작 180미터에 불과 . 2007년 (일본의 해양 탐사선 지큐 호)에 대양저로부터 7,000 미터 시추할 계획 이 깊이는 지금까지 있었던 최대 해양 시추 깊이의 3배에 달함 . 맨틀 암석을 채취하는 데에 해양지각을 시추하는 이유는 해양지각이 더 얇기 때문임
■ 규소와 생물
□ 규산 Si(OH)4 ウィキペディア(Wikipedia)자료 인용
규산 (silicic acid, Si(OH)4), 몰 질량 96.1149 g mol-1, 밀도 1.576 g cm -3
규산(珪酸、Silicic acid)은 화학식 (SiOx(OH)4 -2x)n으로 표시되는 규소, 산소, 수소 화합물의 총칭이다. 확인된 것으로는 metasilicic산 (H2SiO3), orthosilicic산 (H4SiO4), disilicic산 (H2Si2O5), pyrosilicic산 (H6Si2O7) 등이 있다. 간단히 규산이라고 부르는 경우 메타규산을 말하는 것이 보통이다.
. 화학적 성질보통 오르토규산 (orthosilicic acid) 등은 단독으로 존재하는 경우는 적고 혼합체로 된 경우가 많다. 또한 메타규산은 단순한 H2SiO3 분자가 아닌 SiO4 사면체(四面体)가 쇄상(鎖状) 또는 환상(環状)으로 된 구조이다.규산나트륨 등의 규산 알칼리의 진한 용액에 산을 가하면 백색 무정형의 아교상태(膠状) 물체로 된다. 이것을 보통 규산이라 부르며, 이산화규소와 물이 결합된 것이지만, 그 물의 비율은 일정치 않다.
이 규산이 응고한 것을 건조공기 중에 방치하고, 다시 가열 건조 시키면 점차 물을 잃게되고, 500 ℃에서 이산화규소의 Xerogels(실리카겔)이 되는데, 그 사이 이산화 규소 1 몰에 대해 일정량의 물이 화합했다고 보지 않기에, 이 젤 형태의 규산을 일정한 화학식으로 표현하는 것이 곤란하다, 이러한 염을 고려할 때, 메타규산(metasilicic acid, H2SiO3)과 오르토규산(orthosilicic acid, H4SiO4)이 존재한다고 생각되는 것이다.
규산은 뜨거운 물이나 알칼리에 녹고, 또한 냉수에도 조금 녹지만 산성에는 녹지 않는다. 진한 황산, 무수 에탄올에 의해 탈수된다. 불화 수소의 작용으로 즉시 분해되어 헥사플루오르규산(H2SiF6)을 생성한다. 수용액은 메틸렌부루에 의해 청흑색(青黒)이 된다.
암석학(岩石学) 등에서는 암석의 조성을 산화물의 비율로 표기하는 것이 일반적이며, 이산화규소를 규산이라고도 한다. 이 이산화규소의 함유량이 많은 것은 일반적으로 유색광물이 적은 "산성암(酸性岩)"이라고 불리는 화강암이 전형적인 예이며, 이산화규소가 적고 유색광물이 많은 것은 "염기성암(塩基性岩)" 으로 현무암이 대표적이다. 더욱 이산화 규소 함량이 적고 산화 마그네슘 함유량이 많은 것은 "초염기성암(超塩基性岩)"이라고 한다.
. 수용액 중의 전리평형(電離平衡)
오루토규산은 화학식상으로는 4가의 산으로 생각된다, 그러나 산해리정수 측정은 1 단계만 분명하고, 2 단계 이후는 매우 약해서 정확한 측정이 곤란하다. 염기성용액 중에서는 H2SiO4 -- 처럼 보여주지만, pH 및 농도에 따르면 중합된 폴리규산 이온도 존재한다.
H4SiO4 (aq) ↔ H+ + H3SiO4 - (aq) pK1 = 9.86
H3SiO4 - (aq) ↔ H+ + H2SiO4 2 - (aq) pK1 = 13.1
H2SiO4 2 - (aq) ↔ H+ + HSiO4 3 - (aq)
HSiO4 3 - (aq) ↔ H+ + SiO4 4 - (aq)
. 규산 이온가장 간단한 구조로는 오루토규산 이온(orthosilicate, SiO4 4 -)이고, 형식적으로는 오루토규산의 4단계 해리에 의해 생성되지만, 수용액 중에서는 아무리 강염기성이라고 하더라도 이러한 이온은 확인되지 않는다. 마그네슘염 즉 감람석 같은 천연광물 중에 존재하고 네소규산염이라고 불린다. 정사면체형 구조로서 철감람석(鉄橄欖石) 결정 중에서 Si-O 결합 거리는 164pm이다.
축합(縮合)하여 2 개의 SiO4 사면체를 산소로 가교(架橋)하는 2규산 이온 (Si2O7 6 -)을 포함하는 광물은 소로규산염이라고 불리는 녹렴석(緑簾石) 등이 있다.또한 SiO4 사면체가 사슬모양(鎖状)으로 결합한 이노규산염 ((SiO3)n 2n -, (Si4O11)n 6n -), 환상구조(環状) 사이클로규산염 ((SiO3)6 12 -), 층상구조(層状)의 휘로규산염((Si2O5)n 2n -) 및 3차원 구조의 텍토규산염 ((AlxSi4- xO8)n xn -)이 존재한다.
규산염(silicate)은 규산 이온을 포함하는 이온 결정이며, 많은 광물의 성분이 되는 것이다.
이산화규소와 탄산나트륨 또는 수산화나트륨을 고온에서 용융하여 규산나트륨을 얻을 수 있는데, 이것은 오르토규산나트륨 (Na4SiO4) 및 기타 규산염의 혼합물이다. 규산나트륨의 진한 수용액을 오토클레이브 압력가마에서 가열 처리하면 물엿 모양의 점도가 높은 액체가 얻어지는데 이것이 물유리 이다.
□ 벼과 식물
. Grass opal
. 플랜트(식물)오팔은 식물 세포조직에 충진된 비결정 함수규산체(非結晶 含水珪酸体, SiO2.nH2O)의 총칭. Phytolith, Opal phytolith, Grass opal 등이라고도 한다. (생물학적 실리카)대나무(벼과)가 유리섬유처럼 잘 휘어지고, 매우 비전도성인 이유는 표피세포와 관다발(維管束)에 규칙적으로 밀집된 플랜트 오팔의 식물골격조직 때문이다. (단 죽탄(竹炭) 상태에서는 높은 전도성을 보임)
양치식물, 이끼식물, 벼과 식물을 비롯한 외떡잎 식물의 잎 부분, 특히 표피세포, 수목류의 유관세포(維管細胞, 관다발세포)나 표피세포와 같은 규소가 집적하기 쉬운 곳에 형성된다. 벼과식물을 중심으로 일부의 종(種)에서는 형상으로 종을 특정 지울 수 있다.
고고학에서 고환경(古環境)을 추정하는 수단으로서 이용되기도 한다.(식물 골격조직). 선인장, 쐐기풀, 가지과 식물, 장미과 식물 등에서 볼 수 있는 식물 몸 표피의 가시와 벼과 식물의 잎 가장자리에 보이는 미세한 톱날이 식물 골격조직에서 파생된 규산 및 규산과 칼슘으로 이루어진 복합성분으로 구성된 유리질의 물질로 코팅된 조직이며, 동물의 비늘과 유사기관이기도 하다 (마찬가지로 규조류의 피각이나 방산충의 골격에도 동식물의 벽을 넘는 유사성이 있다). 고환경(古環境)의 추정에 이용되는 분석방법으로 화분(花粉)을 들 수 있는데, 건조지역이나 산성토양 등의 보존이 어려운 환경에서도 화분(花粉)은 남아있기 때문에 다양한 환경에서도 고고학적 분석이 가능하다. 고고학에서 유적지의 구황작물(救荒作物) 성장 가능성이나 벼농사의 전파 경로 연구 등에 이용된다.
□ 규조 (珪藻)
. 세포 구조모든 규조(珪藻)류는 광합성을 하는 독립영양 생물세포 내에 1개 또는 다수의 엽록체를 가진다. 광합성 색소로서 갈조류 등과 같이 着色料 Chlorophyll a, c1, c2를 갖는다. 보조색소로는 Carotenoid(천연에 존재하는 색소)인 Fucoxanthin, 디아토키산틴, 디아디노키산틴, β 카로틴 등이 포함된 황갈색을 나타낸다. 엽록체 세포막은 4 중막으로 홍조류의 이차 공생에서 유래된 것으로 보인다.
엽록체는 세포 주위에 배열되는 것이 많다. 핵은 세포의 중심 부근에 위치하고 그 주위를 발달한 액포가 둘러싼다. 미토콘드리아는 관상 크리스테(tubular cristae, 내막이 접혀 생기는 돌출부위)로서, 세포질 내에 분산되어 배치되어있다.
우근형(羽根型, 깃털뿌리모양) 편모를 가진 Stramenopiles의 한 원인으로서, 규조의 보통세포(껍질에 들어있는)는 편모를 가지지 않고, 중심규조의 선주(遊走)세포만이 편모를 갖는다. 遊走의 편모는 앞 편모의 한 개로서 양우형(両羽型), 내부 미세 관배열(管配列)은 일반적인 9 +2 구조가 아니라, 중핵 대 미세 혈관이 빠진 9 +0 구조이다. 편모소모(鞭毛小毛)는 다른 부등모조(不等毛藻)와 마찬가지로 3 부분으로 구성되어있다.
. 세포 외부의 조직구조규조는 단세포 생물로서는 다채로운 세포 외부의 매트릭스를 갖는다. 규조의 대다수는 피각(被殻)에 진상돌기(唇状突起, 입술 모양 돌기, labiate process)라는 속이 빈 관이 있고, 여기에서 점액 물질을 세포 밖으로 분비한다. 특히 중심규조로 플랑크톤으로서 생활하는 것은 점성이 높은 점액이 유기돌기(有基突起, strutted process)를 형성하여 세포에서 방사상(放射状)으로 뻗친다. 이것은 바다에서의 세포의 침강을 저지하고 세포를 빛이 존재하는 유광층(有光層)에 머무르게 하는 운동이라고 여겨진다.
우상 규조(羽状 珪藻)의 일종은 피각에 세로 홈이 있고, 홈의 축 방향으로 물체 위를 미끄러지듯 운동한다 (1 - 25μm/s 정도). 이 세로 홈 내측 세포막 바로 아래에 액틴필라멘트가 배치되어 있고, 동시에 세로 홈에서 점액 섬유가 분비된다. 이 섬유는 세포 내에 회수되지 않고 물체 위에 남는 것으로 보이지만, 세포 이동의 구체적인 메커니즘에 대해서는 불분명한 점이 많다.
한편, 고착성(固着性)으로서 군체(群体)의 우상 규조(羽状 珪藻)는 세포 밖으로 한천물질(寒天質)을 분비하여 나무 모양의 무늬를 형성하여 군체(群体)를 이루는 것도 있다. 특히 Cymbella 속(属)이나 Licmophora 속(属)은 대형의 아름다운 군체를 만든다.
. 피각(被殻)규조 껍질은 도시락 상자처럼 큰 겉껍질의 안쪽에 소형의 안껍질 (각각의 반껍질; theca라고 불리는)이 결합된 구조로 되어 있다. 뚜껑과 바닥면을 각면 (殻面, valve face), 옆에서 본 것을 대면 (帯面, girdle face)이라고 한다. 대다수의 규조가 이 2 면이 직교(直交)하기 때문에, 대부분의 경우 광학 현미경에 의한 관찰에서는 어느 한 면만 보이는 것이 된다. 일반적으로 규조류 현미경 사진은 껍질 표면(殻面)의 형상을 찍은 것이다. 각면((殻面)은 변화가 풍부하지만, 대면 (帯面)은 대부분의 경우 직사각형인 장방형으로 보여서, 모양의 차이를 파악할 수 없다. Campylodiscus 같이 피각 전체가 꼬여있는 규조도 있다. 피각은 흉문(胞紋, areola)이라는 작은 구멍과, 그것이 배열된 조선 (条線, stria)이 다수 존재하며, 이들의 수나 배치는 분류 형질로서 이용되고 있다.
. 규산 대사(珪酸代謝)규조(珪藻)에 대해 오래 전부터 피각의 형성기구며, 규산대사(珪酸代謝) 메커니즘에 대한 연구가 진행되어왔다. 1999년에는 규산을 과립 형태로 응집시킨 단백질인 실라핀(Silaffin)이 Cylindrotheca fusiformis의 피각(被殻)에서 정제시킴으로서, 종래의 구조학적 측면에 추가하여 피각 형성의 화학적 연구에 커다란 진전이 소개되기도 했다. 또한 규산 세포내의 대사에 관련된 유전자도 Thalassiosira나 Nitzschia와 같은 대표 속(属)에서 많이 보고 되고 있다.
피각(被殻)의 형성에는 규산(珪酸) 섭취가 필수적인데, 이와 경쟁적으로 섭취되는 이산화게르마늄을 규조 배양에 첨가하면 피각이 형성되지 않을뿐만 아니라 규조는 사멸하게 된다. 규조뿐만아니라, 같은 부등모식물문(不等毛植物門)의 황금색 조류에서 규산질의 비늘모양(鱗片)을 갖는 조류 등에서도 같은 형태의 효과가 있다. 이산화게르마늄은 규산을 이용하는 조류에 대해 생육을 매우 선택적으로 차단하는 작용이 있기 때문에, 이들의 번식을 원하지 않는 배양을 할 때 위력을 발휘한다.
. 화석피각(被殻)은 그 재질로 퇴적물에 잔존하기 쉽고 미세 화석으로서 대량 출토한다. 규조 피각(珪藻 被殻)이 그 대부분을 차지하는 퇴적물을 규조토라고 한다. 규조 화석으로서 가장 오래된 것은 독일 북부에서 1 억 8500년 전의 지층에서 발견된 것이 있다. 화석화 되기 쉬운 규조이기는 하지만, 백악기 이전의 것은 황철광이나 오팔 등으로 변한 경우도 많고, 규조류였다는 사실을 모르게 된 것도 있다.
. 분포담수나 바닷물에 이르기까지 폭 넓게 분포한다. 해양 생태계에서는 1차 생산자로서 큰 생태적인 지위를 차지하는 반면, 대형 발생하는 적조를 일으키는 원인이 되는 경우도 있다. 육상의 물에서도 중요한 생산자로서 어류의 먹이로 중요하다. 민물에서 보이는 갈색의 소위 "이끼"는 소태(蘚苔) 류가 아니라 주로 규조류 집단(군체, 群体)이다. 플랑크톤 량이 적은 흐르는 물에서는 벤토스로서 존재하고 강바닥 돌 표면에 부착하여 은어 등의 먹이가 된다.
규조는 pH 1.2의 강산성의 온천에서부터 pH 11의 강알칼리인 마가디 호수와 같은 염기성 호수에까지 넓게 분포한다. 그 외에도 높은 염농도의 내륙 호수나 강한 부식수역 등의 극한환경에서도 생육한다. 극 지방의 유빙(流氷) 바닥면에도 저온성 규조가 서식하고 있는데 이것을 특히 해빙조류(海氷藻類, ice algae)라고 부른다. 그러나 빙하 표면의 설면이나 빙하 내부에서 성장하는 빙설 조류(藻類)라는 조류가 존재하지만, 이는 대부분 녹조류(緑藻類)의 한 종류이다. 일부 규조에서는 유공충(有孔虫)의 세포 내에서 공생하는 경우가 보고되고 있다. 공생하는 규조는 피각이 없는 상태이지만 유공충의 세포 내에서 벗겨지는 피각을 형성하고, 자유생활을 한다.
. 무성생식(無性生殖)
규조류는 일반적으로 2분열에 의한 무성적 증식을 한다. 세포분열은 피각 중에서 진행하고, 두 개의 딸세포는 모세포의 외각과 내각의 내측에 각각 새로운 반피각을 형성한다. 이어서 모세포의 반피각은 각각 하나씩 딸 세포에 분배된다. 그 결과 딸 세포 하나는 모세포와 같은 크기 (의 피각)이지만, 다른 하나는 내각을 외각으로 이용하고 있기 때문에 모세포보다 작아진다.
. 유성생식(有性生殖)위에서처럼 무성생식을 반복한 개체군은 세포의 평균 크기가 감소하는 것이다. 이것을 회복하기 위해 어느 정도 작아진 세포에서는 유성생식이 이루어진다. 중심 규조에서 감수분열을 하고 한 개 편모의 선주세포(遊走細胞)를 내고, 이것이 다른 단상의 개체 (선주세포가 아닌)와 결합하여 증대포자(増大胞子)를 형성한다. 증대포자는 피각을 가지지 않고 성장하여 체적을 키우고, 적당한 크기의 일반 세포로 돌아간다. 우상규조(羽状珪藻)의 감수 분열에서는 동형 배우자(同形配偶子)가 형성된다. 이 접합자가 피각을 통해 근접하고 원형질을 아메바 모양으로 변화시켜 접합, 증대 포자(増大胞子)를 형성한다.
□ 식물에 대한 규산의 효과
작물시험장 강.양순, 자료 중에서 인용
. 토양과 식물체에서 규산의 존재양식 및 기능
규산은 토양의 1차 광물에서 해리되어 식물뿌리에 공급된다. 식물뿌리에서 흡수한 규산은 도관에서 증산류를 따라 수동적 이동하여 잎의 표피와 모용 부위에 주로 집적되고 나머지는 세포벽 간극, 세포 내 소기관의 막과 RNA와 DNA에도 존재하지만 재이동은 거의 되지 않는다.
토양에서는 고상과 액상으로 존재하고 식물이 직접 이용할 수 없는 광물형태나 amorphous형태로 존재하는 규산들은 기상, 토양 물리․화학성의 상호작용으로 용해되며, 토양의 pH에 따라서 분자상(H4SiO4, H3SiO4 -, H2SiO4 2-, HSO4 3- 및 SiO4 4-)으로 변화되는 monosilicic acids와 이들의 복합체인 polysilicic acid(n(SiOH4)), Al, Fe, Ca, Na, MgSO4 등과 무기화합물로 된 복합물, 그리고 유기 규산 복합체로서 존재한다. 식물에는 주로 H4SiO4 형이 잘 흡수되고 이온형은 다른 무기이온과 길항으로 흡수가 억제된다.
규산의 해리는 pH가 낮아지거나 양이온 함량이 적을수록 증가된다. 규산을 시용하면 토양 표면적이 증대되어 물, 인산, 칼륨, 질소, Al, 중금속 등을 물리적 화학적으로 흡수케 한다. 특히 토양중의 규산은 특정원소의 양이 지나치게 높아지는 것을 막아 주고, 낮아지면 해리되어 공급하는 일종의 양이온 완충기능을 한다. 식물이 주로 흡수하는 monosilicic acid는 화학특성을 조절하고 polysilicic acid는 토양 물리성을 조절하며 양자의 상호작용으로 토양 pH에 영향을 준다. 토양 pH 6에서는 분자상 규산인 H4SiO4 형태로, pH 7~10에서는 H2SiO4 2-로, pH 10~11에서는 H3SiO4 -로, pH 11이상에서는 SiO4 4-로 존재하면서 약간씩 혼합되어 있다.
벼 뿌리에서 흡수된 monosilicic acid는 식물체내에서 이동 중에 온도와 pH 반응으로 산처리 되면 polysilicic acid로 중합되어 amorphous silica로 되고 polysilicic acid특성을 갖는 si-o 네트구조로 조직세포에 부착된다.
Silica gel 이나 opal(phytoliths)과 같은 amorphous silica와 quartz 같은 crystaline silica는 근본적으로 polysilicic acid이다.
이들은 총 규산의 90%이상이 되고 orthosilicic acid인 저분자 silicic acids는 뿌리에 주로 분포되어 8%를 차지하며 엽신에는 0.5% 함유되어있다.
식물체내에서 규소의 이동은 분포상태로 평가되지만 어떠한 형태로 이동이 되는지는 불분명하다. 그것은 규소의 isotope(29 Si) 반감기가 2시간 7분으로 매우 짧기 때문에 이동성 연구가 어려운 분야이다.
식물체에 집적된 규산은 조직을 물리적으로 보호하고 표피조직을 통해서 배출하는 수분을 막아주는 기능을 한다. 식물세포 내에 존재하는 용존규소는 에너지를 합성하는 세포 소기관(미토콘드리아, 엽록체 등)과 RNA와 DNA에 존재하면서 세포막의 안정성과 생리․생화학적 반응에 관여하여 불량환경에 대한 내성을 높여준다.
벼 조직에 집적된 규산체의 형태는 도관으로 이동하는 silica gell이 중합되어 Si-O-Si band로 집적되고 표피세포 아래 silica 이중층을 형성한다. 마이크로톰으로 엽의 단면을 잘라서 광학현미경으로 볼 수도 있고, 조직을 불화수소에 처리하면 규소가 휘발되어 그 흔적의 영상으로 집적양상을 알 수 있으며, 유기물 분해제에 처리하여 남은 규산체(opal, phytolith)의 형태도 관찰할 수 있다.
규산 흡수가 비교적 적은 오이의 표피조직에서는 모용 기부 둘레에 둥근 반점 모양으로 집적된다. 규소는 식물 조직의 빈 공간에 구조 모양대로 부착 집적되므로 규소의 형태로서 식물의 조직 구조 까지도 추정이 가능하다.
. 규산질 비료의 이용 역사
초기 농학자들은 식물체의 재를 규산비료로 이용하였다. 기원전부터 로마인과 중국인들은 식물체의 재와 보릿짚을를 토양개량제로 사용하였다. 8세기에 영국의 Valter Henli가 곡류의 경엽을 비료로 사용할 것을 제안하였고, 1814년에 영국의 Davy가 자연에서 규산을 조사하였다. 1840년에 Liebig는 Na-silicate을 사용하여 사탕무우시험을 실시하여 독일, 영국, 일본, 러시아, 미국으로 확산되는 동기를 마련하였다. 1842년에는 Bergelius에 의해서 규소원소가 발견되었고, 1856년 Lawes에 의해서 규산질 비료의 포장시험이 최초로 실시되었다. 1881년는 미국에서 Si Slag를 비료로서 사용하여 첫 특허를 확보했다.
비료로서 본격적인 연구는 1870 Mendelear(러시아)가 amorphous silicate(SiO2, CaSiO3)를 비료로 사용할것을 제안하였고, Albreht(1938)가 콩에 대한 규소효과 첫 시험을, 러시아에서는 식물병저항성 효과 첫 시험이(Krenzhage, 1884), 일본에서는 벼에 대해서 onodera(1917)가 첫 연구를, 중국에서는 첫 보고로 Steel slag를 이용한 작물에 대한 규소효과(Zhu, Chan, 1963)등의 연구가 있었다. 우리나라에서는 1950년대부터 연구를 하였으나 기록은, 없고 벼의 호마엽고병에 대한 규소 연구가 최초로 보고된 이후로 토양 규산 연구는 Park에 의해서, 벼에 대한 규산 생리연구는 Kang에 의해서 많이 이루어져 ‘90년대까지 진행되었고 최근에는 벼 이외 작물에서도 활발한 연구가 진행되고 있다.
최근 규산 연구의 특징은 벼와 사탕수수 등 화본과에서 밭작물로 확산되고 특히 병해경감연구는 원예작물을 대상으로 캐나다, 미국 및 유럽에서 많이 연구하고 있으며 미국과 일본에서는 규산질비료 개발이 활발하다.
규산질비료로 공급되는 규산은 주로 양이온과 짝을 이루고 있어 해리가 잘 되므로 토양 중의 양분균형에 큰 영향을 미친다.
규산과 양이온과의 존재양식은 CaSiO3, Ca2SiO4, MgSiO3, Mg2SiO4, K2SiO3, MgCa(Sio3)2, Na2SiO3, Al2SiO5, FeSiO3, ZnsiO3, CdSiO3, RbiO3, 등으로 결합되는데 이들 중 Zn, Pb, Cd은 잘 해리되지 않고 pH가 높아지면 그 양이 증가한다. 일반적으로 보급되는 규산은 규산유효화율이 높은 Wollastonite β-CaSiO3로서 가장 경제적인 소재이다. 규산질 비료에는 광재를 원료로 하는 규산질(25%) 비료와 여기에 인산액을 원료로 하는 규인비료(15%)및 규인가리비료(15%)가 있다.
K2SiO3는 엽면시비용으로 적합하고 Na2SiO3는 실험실용으로 적합하며, 최근에 각종 용도로 사용되도록 개발된 silica gel은 Na free source silica로서 일본에서 어린모 육묘 상토로 개발하고 있다. 다공성 수화칼슘규산질비료로서는 건축 자재로 쓰여지는 경량다공콘크리트(ALC) 중의 규산질을 유효화 할 수 있는 연구도 한국에서 수행되었다. 규산질 비료제품의 형태별 특성은 표1에서와 같이 규산질비료는 강알칼리성이고, 규산함량은 액상보다 고상이 높으며, K-silicate > Na-silicate > Ca-silicate 순이고, 우물에는 빗물(60 mmol)보다 3-4배 높은 농도로 용존한다.
. 규산의 시용효과
규산질비료를 토양에 시용 하면 토양개량 효과와 병충해, 기상재해 및 독성 등 불량환경에 대한 내성 증진과 수분 이용 효율을 증진시켜 작물의 생육 환경이 개선되고 생리활성을 촉진시켜 증수를 가져온다.
규소는 토양 중에서 표면적이 확대되어 물, Al, P, K, 중금속 등을 흡수하여 영양의 과잉이나 결핍 등 불량환경에 대한 내성을 갖게 하며 누수답에서 물의 지하 침투를 막아주는 효과도 크다. 토양개량효과로 한국의 논토양에서 유효규산은 130ppm에서, 미국과 중국에서는 180ppm에서 적정수량을 낼 수 있는 요구 농도이고, 밭 토양에서는 중국에서 220ppm이 요구된다.
논에 규산을 시용하면 토양 양이온 증가와 벼의 N, P, K, Ca, Mg, Si 흡수를 촉진시킨다. 특히 벼와 밀에서는 규산 공급으로 독성이 강한 게르마늄(Ge) 흡수를 억제하여 식물조직의 게르마늄 독성을 경감시킨다.
토양에서 흡수된 분자상 규산은 망간의 흡수를 억제하여 망간 과잉장해를 막고 지상부 식물체로 이동되며 뿌리에는 일부분만이 집적된다. 벼 뿌리의 규산 흡수는 늙은 뿌리가 주로 하고 어린 생육단계에서는 지상부의 규산 집적공간이 크지 않으므로 거의 뿌리에 집적되고 생육이 경과될수록 급속히 지상부로 이동되어 집적된다. 잎에 규산이 집적되면 잎이 곧바로 서게 되므로 광 투과를 좋게 하고 엽록소 파괴 물질인 에틸렌 생성을 현저히 줄여서 광합성에 기여하고, 한편으로는 질소대사과정에서 에틸렌 호르몬과 암모니아를 방출시키는 물질 생성을 줄어들게 하여 엽신의 노화를 억제시키고 엽신으로 손실되는 질소휘산을 경가만다. 광합성 물질은 규산과 칼리에 의해서 전류가 촉진되므로 등숙이 양호해지고 품질이 좋아지며 결국 수량이 높아진다.
또한 잎과 왕겨에서는 규산이 망간분포 변화를 일으켜서 독성을 경감시키고 집적된 규산체는 병해충의 물리적인 공격을 방어하는 방파제로서의 기능과 증산을 억제하여 한발장해나 염류장해를 경감 시킴으로서 불량환경에 대한 내성을 갖게 하여 등숙과 품질향상으로 수량을 높인다.
그리고 줄기와 잎짚에 규산이 축적되면 조직이 강건하여 도복저항성은 물론 병해충에 대한 내성을 갖게 되므로 양호한 등숙과 품질 향상으로 수량에 기여하게 된다.
세포조직 내에서 규산은 틸라코이드막 형성에 K, Ca, Mg 등 다양한 이온과 상존하고 있어 저온 시에 냉해를 경감시킨다. 또한 규산질 비료는 벼 엽신의 기공크기와 수를 조절하여 수분이용효율을 증진시키고 등숙을 양호하게 하여 품질을 향상시킨다.
벼에서 규소는 표피 및 큐티클과 규산 2중층 사이에 두고 축적되지만 벼에서 규소는 주로 식물체 용액상태로 RNA와 DNA, aleurone, 엽록체, 미토콘드리아에 1~5% 정도 용존 하면서 생리생화학적 기능을 수행한다.
특히 식물체내에서 에너지 생성조직 부위인 종자 피티층 aleurone와 광합성 주체 부위인 엽록체와 호흡대사를 일으키는 미토콘드리아에 많이 분포된다는 사실이 흥미꺼리이고 엽록체에서는 광인산화반응, 미토콘드리아에서는 산화적 인산화로 Aleurone에서는 발아에너지로 ATP 생성에 참여하는 인산의 기능을 대체한다고 보고 있다.
규산은 생체 내에서 Si-O-Si bond로 존재되는데 Si-O-P bond로 쉽게 전환되는 사실이 증명되었고 수용액 Si와 P조절로 생체내 RNA에서 분포가 증명되어 인산 대체설이 유력하다. 또한 세포막이나 세포 소기관 막의 안정화와 세포물질에서 수분보유능력을 키움으로서 중금속, 독성, 재해경감 능력을 갖게 한다. 규산은 식물체의 온도 조절기능으로 고온과 저온장해를 경감시키고 외부 전기적 충격을 완화 시킴으로서 재해에 대한 내성을 높인다.
증수효과로는 기상과 토양 환경을 고려하여 국가별, 작물별로 보면 세계적으로 벼에서는 10~46%의 효과가 인정되는데 특히 미국에서 21~46%의 가장 높은 효과를 내었다. 밀, 보리, 옥수수에서는 10~15%의 증수를, 사탕수수에서(브라질)는 5~13%, 땅콩은 15~25%(중국), 오이에서는 3~10%, 토마토에서는 82~91%, 장미는 4~8%의 증수를 가져왔다. 토마토에서는 작물 중에서 규산을 가장 적게 흡수하면서도 개화 후 임성과 관련이 커서 수량에 결정적으로 영향을 주게 된다.
불량환경 내성 면으로는 규산 시용은 병, 해충에 내성을 갖도록 하고 Al 독성이나 P 결핍 및 Na, Mn, N 과잉 스트레스를 경감하며, 기상 스트레스로는 저온장해, 냉해, 태풍 및 일조부족 등에 내성을 갖게 된다. 특히 규산과 칼리는 동조적으로 물질의 전류를 촉진시킴으로 일조부족 스트레스에 대한 경감효과가 커서 최근 기후변동으로 늦장마에 따른 일조 부족 시 규산질비료 효과가 등숙에 유리한 역할을 할 수 있을 것이다.
벼에서는 도복, 한발, 냉해, 일조부족 및 염해에 대한 내성을 갖게 하여 피해를 경감시키고 벼, 사탕수수, 보리, 감자에서 일조부족에 대한 내성을 갖게 하며 옥수수는 한발에, 잔디는 고온에 저항을 갖게 되고 특히 잔디는 밟을 때 저항력을 갖게 된다.
벼에서 발생되는 모든 병해와 충해는 거의 경감되는데 도열병 경감 기작은 명확히 밝혀져 있지 않으나 잎에 집적된 규산체나 체내 용존규소가 도열병포자 발아와 발아기간을 지연 시킴으로서 병반 수와 크기, 면적을 감소시키는 slow blasting 효과로 병 격발을 막는다.
단자엽과 쌍자엽 식물에서 모두 잘 발생되는 phythium, root rot 및 흰가루병에 대한 내성 기작도 명확하지는 않으나 많은 연구 결과로 그 억제 능력이 큰 것으로 보고되고 있다. 뿌리 조직으로 침투되는 병으로 phythium, root rot은 규소가 뿌리 세포간극에 집적되어 병원균이 접근되면 밀어내는 물리적 차단 기능을 하거나 기주와 병원체간에 작용으로 자기를 방어하려는 특성으로 알렐로파시 물질인 페놀 화합물등 phytotoxin을 생성하고 또한 효소활성도 증가하여 강건한 식물체를 만든다.
한편 잎 조직으로 감염되는 흰가루병은 병원균이 침투되면 세포간극이나 잎 표면과 모용에 규산 집적이 많아지고 특히 병원균을 둘러싸서 물리적으로 생장조건을 불리하게 함으로서 균사신장을 억제시키고 발육을 저해시킴으로서 방제되며 동시에 페놀성 물질 등 균사 저해 물질을 생성하여 병발생을 경감시킨다. 오이 식물체에 흰가루병을 접종시키면 규산이 병원균의 흡입기에 집중적으로 분포되어 병원균의 발육을 억제시킴으로서 피해를 경감시킨 결과로 보아 병반이 발생된 미세 공간으로 colloidal 규산이 침투될 수 있는 기회가 될 것이므로 엽면 살포 효과가 클 것으로 보이는데 금후 면밀한 검토가 필요하다.
규산 공급으로 벼는 Al, Fe, Mn, Ge, As, Cd 등의 독성금속이나 중금속에 내성을 갖게 되고 질소과잉 장해를 완화시켜준다. 콩, 오이, 딸기, 토마토에서는 인산과다 장애를 경감시켜주고 밀, 옥수수, 수수, 목화에서는 Al 독성을 경감시켜준다. 그리고 과수에서는 Mn 과다를 경감시킨다.
오이에서도 규산 시용으로 엽록소 함량이 증가되었으나 광합성과 수량성에는 기여하지 못하였다.
토양재배한 원예작물의 규산 흡수량은 오이=Aster>멜론>Gherkin> courgette> 팥>딸기>장미 순이고 토마토, 상치, 풋고추, 카네이션, 거베라는 적게 흡수하는 편이다. 한편 양액재배에서는 오이> courgette>딸기>aster>장미가 많이 흡수하여 토양재배와 같은 경향을 보이나 특이하게도 메론, gherkin, 및 팥은 토양에서는 많이 흡수하지만 수경재배에서는 흡수치 않는 작물간의 특성을 갖고 있다.
모든 작물 중에서는 카네이션이 토양과 양액재배 모두 흡수는 적지만 어떤 형태로던 규소효과가 주목되고 특히 토마토는 흡수는 적지만 개화시에 임성을 좋게 하므로 수량에 기여되는 효과가 매우 크다.
수분 이용 효율 증진 면으로는 벼 조직의 큐티클-규산 2중층은 식물 자체가 조절할 수 없는 큐티클층을 통해서 증산되는 손실을 규산 시용으로 33%나 줄일 수 있다.
포장조건에서도 규산 시용으로 관개량을 14%나 줄일 수 있는데 그것은 증산억제와 누수억제 효과로서 물절약형 재배기술을 위한 소재로서도 높게 평가할 가치가 있다. 벼에서 규산 시용에 의한 증산율 감소는 광도 변화에 따른 잎의 비전도도감소가 빠르고 대기습도가 낮은 건조 시에도 기공의 비전도도가 낮아지게 되어 증산율이 감소된다. 고온으로 야기되는 세포 내 전해질 유출도 규산 시용으로 세포막 점성이 증가되어 수분 결핍에 저항성을 갖게 된다.
□ 규소 비료의 효능
비료 관련 특허 (미국) 자료 중에서
U.S. Pat. Nos. 5,743,934 and 5,997,599
http://www.patentstorm.us/patents/6939387/description.html
Vaporizing and Heating Equipment for Polysilicon Production Process
어느 식물군은 질소, 카리, 인 등의 주요 다량영양소 보다 더 많은 다량의 규소(Si)를 토양에서 섭취한다. 규소는 식물의 수율 상승으로 수익을 향상시킨다. 이것은 토양의 물리적 특성을 향상시키며 병충해에 대한 저항력과, 철 망간과 같은 독성인자에 대한 내성을 키워준다.
토양에는 다양한 서로 다른량의 규소가 포함되어 있다. 예를 들면 점토에는 40~70%의 이산화규소(SiO2, 실리카)가 있으나, 규사 모래에는 90~98%의 실리카(SiO2)가 있다. 게다가, 규소는 규산염, 즉 규산으로부터 유도된 염이나 에스테르 형태를 이루고 있다. 그렇지만 규산염은 식물이 받아들일 수 있는 규소의 형태는 아니다. 식물이 동화할 수 있는 규소는 monosilicic acids (H4SiO4) 이다. 식물은 70~700 Kg/ha 의 규소를 토양으로부터 받아들인다.
규소는 벼나 사탕수수 생육에 필수적이며 생산성 향상에 중요하다. 규소는 도열병, 붉은점무뉘병, 벼잎집무뉘마름병, 줄기썩음병, 벼갈색잎마름병 등의 병해 저감에 기여한다. 벼가 논의 토양으로부터 흡수하는 규소량은 쌀 5톤/ha의 곡물 생산량 당 230~470 kg Si/ha (500~1000 kg SiO2 /ha) 이다. 초기에 규소 공급이 충분한 논이었다할지라도 해가가면 토양에 규소를 보충해 주어야만 하게 된다.
flatwood soils 등의 토양은 낮은 수준의 가용규소를 포함하고 있으며 산성토양들이 많다. 식물들은 가용규소를 토양으로부터 자기 조직으로 흡수하는데, 가용 규소가 고갈되는 것이다. 이 규소결핍은 경작자가 토양의 가용 규소 수준을 높이기 위해 또 다른 물질을 보충하여 줘야만 된다.
많은 경우에 산성토양에 석회(CaO)를 시비하여 줌으로서 적당한 산도를 유지시켜 인, 카리, 질소 등과 같은 영양소를 향상시키고 망간이나 알미늄과 같은 독성 수준을 낮춰준다.
“Reclime® (상표명)” 성분은 칼슘(26%~28%) 마그네슘(6~8%), 탄산칼슘 상당량(90~100%), 가용성 규소( 10 lbs/ton 이상)을 포함한다. 이것은 석회처럼 토양의 적정산도를 유지시키고 가용성 규소가 공급될 수 있도록 처방된 것이다. 여기서 규소는 가용성인 MgSiO3 로부터 식물로 쉽게 공급된다.
도로마이트((Dolomite, 칼슘탄산마그네슘, calcium magnesium carbonate, CaMg(CO3)2)는 마그네슘 공급원의 비료로 널리 이용되어 왔으며, 규산칼슘(Calcium silicate, CS, CaSiO2)은 광산 부산물로 나오는데, 작물의 규소 공급원으로서 농업용으로 재활용되어 왔다.
규소는 약산성 상태에서 용해성을 가지므로 토양을 통해 식물의 뿌리로 이동될 수 있다. 그런데 벼 작물의 성장초기에 CS 슬래그를 시비하면 토양의 PH와 칼슘 농도가 상승한다. 그러나 토양에 마그네슘을 공급하지는 못하기 때문에 별도로 마그네슙 공급원을 추가해야만 하고 이는 결국 토양 처리비용의 상승를 초래하게 된다.
특허 발명의 목적; 가격경쟁력이 있는 농업용 토양개량제의 개발
규소, 칼슘, 마그네슘, 황의 유효한 조성;
(조성의 예시 1)
입자형태의 조성은 규산칼슘(calcium silicate, CaSiO2) 슬래그 함량 65~90% (wt), 발전소 부산물인 황산마그네슘(magnesium sulfite, MgSO3) 함량 20~30% (wt), 점토 0~5%, 잔류수분 2~10%로서, 그 성분은 규소 31% (wt), 칼슘 22% (wt), 마그네슘 3% (wt), 황 4% (wt)
. 적용 및 효과
잔디, 사탕수수, 벼, 밀, 보리 등의 단엽식물, 오이 도마도 등의 이엽식물 등에 적용
토양의 가용 규소량을 증대시켜 주므로서 작물을 단단하고 크게 하여 저항성을 배양해 준다. 식물에의 규사 공급은 잎의 클로로필(chlorophyll) 함량이 증가하면서 식물의 대사를 촉진시킨다. 추위 더위 가뭄, 부족한 영양소나, 금속독성 등과 같은 환경적 스트레스 요인에 대한 내성을 키워주고, 세포벽을 강화해 준다. 규소는 식물의 기계적 강도를 높여 병원체나 해충으로부터 보호한다.
. 제조공정, 작물시험결과 예시 등 …… (중략)
□ 수용성 규산염 (분자식, Na2O-nSiO2-xH2O)
카테고리 "원적외선" 중에도 중복 게재함
. 규산나트륨(규산소다)은 수용성 규산염 중 가장 널리 사용됨
. 물에 대한 용해성이 있어 물유리(water glass)라함
. SiO2/Na2O 의 몰비와 농도에 따라 다양한 성질을 나타냄
. 액상규산나트륨의 몰비(molar ratio) 계산은
= SiO2 / Na2O 의 중량비 * 1.032
. 한국산업규격 KS M 1415 (규산 나트륨)
| 1종 | 2종 | 3종 | 4종 | |
| 비중(20°C) | 1.690 이상 | 1.590 이상 | 1.380 이상 | 1.260 이상 |
| 물불용분(%) | 0.2 이하 | 0.2 이하 | 0.2 이하 | 0.2 이하 |
| Na2O (%) | 17~18 | 14~15 | 9~10 | 6~7 |
| SiO2 (%) | 36~38 | 34~36 | 28~30 | 23~25 |
| Fe2O3 (%) | 0.05 이하 | 0.05 이하 | 0.03 이하 | 0.03 이하 |
| 주요 용도 | 요업, 용접봉 |
합성세제, 건축용 |
주조용 바인더, 제지 |
토목 점결제 단열재 바인더, |
. 반응 특성
. 산과 반응
. 액상규산나트륨에 산을 첨가하면 중화반응에 의해 pH가 낮아지고,
. 규산이온 또는 폴리규산이온 끼리의 중합 진행으로 점도 상승, 더욱 진행하면 겔(gel)화
. Na2O·nSiO2+H2SO4+(m-1)H22O → nSiO2·mH2O+Na2SO4
점도 상승, 겔화 속도는 산의 종류, 첨가량, 농도, 온도 등에 따라 다름
. 금속이온과 반응
. 액상 규산나트륨은 Ca, Mg, Al, Ba 등의 금속 이온들과 반응하여 불용성의 규산염 금속수화물 및
규산염 금속수산화물, 규산 등을 동시 생성하여 겔화됨
. Na2O·nSiO2+Ca(OH)2+mH2O → CaO·nSiO2·mH2O+2NaOH
이 같은 반응으로 생성되는 규산화합물은 금속이온과 규산이온의 존재량에 의존함
. 유기화합물과 반응
. 글리옥살이나 에칠렌글리콜디아세테이트 등의 다가 알코올과 초산에스테르는 모두 알카리
존재 하에서 글리콜산이나 초산을 생성하고 중화작용에 의해 규산나트륨을 겔화됨
. 메칠알코올, 에칠알코올, 아세톤 등의 유기용매를 가해도 겔화 되나
단순히 탈수에 의한 것으로 물을 가하면 다시 용해됨
. 탈수에 의한 경화
. 알코올에 의해서도 규산나트륨은 겔화 됨
이것은 결합수로서의 규산나트륨 중의 H2O가 탈수되면서 SiO2 사면체의 중합이 일어나는 것
그 결과 견고한 필름을 형성
. 100%의 탈수는 1,000 ℃ 이상이 아니면 불가능하며, 그 과정을 보면
120~500 ℃ 에서 다공질화를 거쳐 600~1,000 ℃에서 유리화 됨
200 ℃에서 95% 정도 탈수가 되며 그 이상의 탈수는 아주 서서히 진행
탈수가 되더라도 물에 대한 용해성 유지
. 용도
. 토양 안정제
. 규산나트륨의 겔화 성질은 토양 안정화 분야에도 사용됨
. 규산나트륨은 화학적 반응에 의해 기공이 많은 토양 구조를 견고화 할 수 있기 때문에
토목기초공사에 널리 사용됨
댐, 탄광, 터널, 기타 굴착공사 시 토양을 안정화 및 견고화 시키고
. 기공이 많은 토양을 규산나트륨으로 안정화 시키면, 규산나트륨의 겔화에 의해서 토양 구조를
개량하여 강도를 향상시키고 투수성을 줄여줌
. ‘화학적 그라우트’제는, 농도, 점도, 겔화 시간이 조정하여 토양에 주입되면 미리 정해진 시간이 되면
경화가 완성됨
. 치과 의료용 (기본 기능의 원리와 배경은 연구대상, 원적외선 관련성?)
. 차거나 뜨거운 음식을 먹을 때 이가 시리다면 잇몸 염증이 원인인 경우가 많다고 함
. 시린 증상이 이어지면 날카로워 진 상아질이 조금씩 부서지게 되며, 심한 경우 치신경이 노출되어
치수염(齒髓炎)을 유발하기도 함. 심한 경우 갑자기 치아가 조각날 수 있음
. 이를 예방하기 위해선 염화스트론튬이나 수용성 규산염이 함유된 치약 사용을 권유
. 동물약품 (기본기능의 원리와 배경은 연구대상, 원적외선 관련성?)
. 생명체에 무해한 면역기능 향상과 성장촉진 기능성 사료로의 개발 가능성
. 잔류 촉진제가 없는 청정육류 생산기술개발이 가능하게 됨
. 사료 첨가제를 탈취, 가스 제거 능력이 탁월한 기능성 사료로 분뇨 처리의 환경공해 문제점 해결
가능성 개발
. 항균, 면역증진제로서 동물 의약품으로 사용가능성 점검
. 기타 용도
. 실리카겔은 액상규산나트륨을 산으로 처리하여 제조
그 때 생성된 규산 침전물을 세척하여 수용성 염을 제거하고 건조
실리카겔의 제조에는 일반적으로 몰비가 높은 규산염이 사용됨
최종 제품은 유리질의 입자로서 내부에 수많은 기공을 갖고 있어
습기, 기타 물질을 흡착할 수 있는 능력이 있음
때문에 탈습제와 쥬스 및 맥주를 정제하는 용도로 사용
. 무정질 실리카 분말은 고무제품에 첨가되어 내마모성을 높임
그 외 용도로는 잉크, 플라스틱, 광택제의 증량제, 도료의 분산제, 살표용 분말, 살충제의
뭉침 방지용 첨가제 등으로 사용됨
. 액상규산나트륨은 많은 수용성 염의 수용액과 반응해서 복잡한 겔(gel) 상의 침전물을 만드는데
예를 들면, 알루미늄염은 액상규산나트륨과 반응해서 나트륨-알미늄 규산염 겔을 형성하며,
이용하여 경수연화(硬水軟化)용 제품을 만들며, 실리카-알루미나형 촉매처럼 촉매물질도 만듬
. 실리카겔 촉매와 유사한 것이 분자체(molecular sieve)인데, 규산나트륨과 나트륨-알루미늄염과
같은 여러 가지 염을 반응시켜 만들고, 내부 기공 크기를 조절할 수 있는 구조를 갖고 있어,
다른 크기의 분자 혼합물을 분리 또는 거르는 역할을 할 수 있음
. 내산, 내화를 요하는 시멘트 모르타르 및 내화연와 등의 점결제
. 농업분야의 규산질 비료
www.kosiplus.co.kr/page/sub2_2
코시플러스 수용성규산염 비료
유기농업자재, 수용성 규산, 4종 복비 제조 및 농업용 자재 공급업체
www.kosiplus.co.kr



□ 규소와 건강식품
건강식품의 안전성과 유효정보
일본, National institute of health & nutrition 자료 중에서
http://hfnet.nih.go.jp/contents/detail579.html
. 개요 珪素, Silicon (Si)、규소화합물 Silicide, 규소는 실리콘이라고도 하며, 비금속 원소의 하나로, 산화물인 규산염이 되어 지표 중에 많이 존재하고 있다. 동식물에서는 골격이나 세포벽을 구축하거나 강화하는 원소로 역할을 하고 있다. 인간에게는 규산으로서 피부 연골 뼈에 존재하고 있다. 그러나 인간에게 규소가 생리학적인 역할에 관여하는 것에 관한 연구는 거의 진행되지 않기 때문에 효과나 안전성에 대해서 신뢰할 수 있는 데이터가 눈에 띄지 않는다.
. 주요 성분 및 특성 원소기호 Si, 원자 번호 14, 원자량 28.0885. 주기율표 14 (4B)에 속하는 비금속 원소. 동물 신체의 모든 조직에 있고, 규산염으로서 털, 날개, 뼈, 피부 등에 존재한다. 식물계에도 널리 존재한다.
. 뼈 및 근육 골다공증에의 유효성이 있다는 보고가 있는데, 규소를 다량 섭취하는 남성이나 폐경 전 여성은 골밀도가 높고 골다공증 위험이 낮은 것으로 보인다. 그러나 폐경 여성에 대해서는 효과가 없는 것으로 보인다. 폐경후 여성에게 뼈 감소는 뼈의 재흡수에 의한 때문인데, 실리콘은 뼈 신생에만 작용하는 것으로 생각된다.
. 안전성. 위험 정보
통상의 식품에 포함된 양의 경우 임신중, 수유중에 포함된 것을 경구섭취하는 것은 분명 안전하다. 의료 목적으로 섭취할 경우의 안전성에 대해서는 충분한 정보가 없다. 따라서 임산부 수유부는 사용을 피해야 한다.
식품이나 음료수에 포함된 규소의 부작용은 보고된 바 없다. 3 규산 마그네슘을 포함하는 제산제를 장기간 섭취하면 드물게 규소 함유 신장결석이 발생한다는 것이 보고되고 있다. 꼭 3 규산 마그네슘을 섭취하지 않더라도 규소 함유 신장결석이 일어날 수가 있다.
대부분의 규소 화합물은 경구 섭취하면 무해하다.
규산 신장 결석을 일으킬 가능성이 있다.
38 세의 백인 여성이 첨가제로 이산화규소가 포함된 영양제 3 종류를 2 년간 섭취 (2 년간 총 규소 섭취량: 35,711 mg)했는데, 규산염 신장 결석증이 발병했다는 보고가 있다.
실리카 분진을 장기간 흡입해서 실리코시스로 밝혀졌다.
장기간 규소를 흡입하여 건강에 피해가 된 여러 경우가 보고 되고 있다.
여자 3명 (37, 45, 48세)이 각각 애완동물용 화장실 모래 (벤토나이트, 주성분: 규산 알루미늄)을
사용했는데, 호흡기 증상 (호흡 곤란이나 기관지염)이 출현했다.
환기와 방진이 불충분한 환경에서 일하던 터키석 분사기 공장 직원 (1-80상자/년 흡연자, 고용 기간 2-20 년) 11명 (19-52세) 중 4 명이 유리규소(遊離珪素)를 함유한 먼지의 흡입에 의한 규폐증으로 진단되었다.
연마재 (알루미늄, 이산화크롬, 규소를 포함)를 사용하는 작업에 수년간 종사했던 66세 여성이 일을 그만 둔지 2 년 후에 결절성강피증(結節性強皮症)이 발병했다.
. 상호 작용
다른 풀과 보조식품, 의약품과의 상호 작용은 알려져 있지 않다.
임상 검사치, 건강상태에 대하여 미치는 효과는 알려져 있지 않다.
. 동물 기타의 독성 시험
고농도의 메타규산나트륨을 섭취한 쥐에서는 SOD 등의 활성이 떨어졌다.
급성독성 : 규소를 쥐에 경구 투여했을 때 50 % 치사량 (LD50)은 3,160 mg/kg이다.
220ppm 이상의 높은 규소 농도 배지에서 황색 포도상 구균에 대한 뚜렷한 증식 작용을 보이고, 배지 중의 고농도의 규소는 세균의 증식, 생존에 유리하게 작용한다는 보고가 있다.
저 규소 농도 배지 (10-45ppm)에 비해 높은 규소 농도 배지 (75ppm 이상)에서 녹농균 (Pseudomonas aeruginosa - H1)의 성장 및 증식을 크게 증진되었다는 보고가 있다.
. 안전성
대부분의 규소화합물은 경구섭취 할 경우 무해하다.
. 유효성
골다공증에 대해 유효성이 시사되고 있다.
결핍될 경우 정상성장이 저해된다고 한다.
■ 각종 규소 화합물
ウィキペディア(Wikipedia)자료 인용
□ 규산나트륨 Na2SiO3
규산나트륨(Na2SiO3, 물유리), 몰 분자량 122.06 g/mol, 밀도 2.4 g/cm3, 고체, 융점 1088 ℃
규산나트륨은 일반적으로 메타규산의 나트륨염 Na2SiO3를 말하지만, 기타 Na4SiO4, Na2Si2O5, Na2Si4O9 등도 있다. 메타규산나트륨은 이산화규소를 탄산나트륨이나 수산화나트륨과 용해시켜 얻어지는 무색 결정(結晶)이다. 물에 녹으며 수용액은 가수분해되어 알칼리성을 나타낸다. 진한 수용액은 물유리라고도 부른다.
. 생성과 반응
이산화규소를 탄산나트륨 또는 수산화나트륨과 가열. 융해하여 얻을 수 있다.
SiO2 + 2NaOH → Na2SiO3 + H2O
SiO2 + Na2CO3 → Na2SiO3 + CO2
물유리의 수용액에 염산을 가하면 규산이 된다..
Na2SiO3 + 2HCl → H2SiO3 + 2NaCl
농도에 따라 모양이 물엿과 비슷하지만, 물유리는 점막을 상할 수 있으므로 자칫 섭취에 주의할 필요가 있다. 무취에 강한 신맛의 자극이 있다.
□ 규산마그네슘 Mg3Si4O10(OH)2, (Talc)
규산마그네슘, Mg3Si4O10(OH)2, 단사정계(単斜晶系), 백색, 경도 1, 비중 2.7
활석은 규산염 광물의 일종, 혹은 이 광물을 주성분으로 하는 암석의 명칭.
활석(滑石 talc)은 수산화마그네슘과 규산염으로 이루어진 광물로서 점토광물의 일종이다.구조식은 Mg3Si4O10(OH)2이다. 사문석(蛇紋石 Mg3Si2O5(OH)4)이 열수(熱水) 변질하거나, 고회석(苦灰石 CaMg(CO3)2)이 접촉. 변성(変成)하여 생긴다.
2Mg3Si2O5(OH)4 + 3CO2 → Mg3Si4O10(OH)2 + 3MgCO3 + 3H2O
3CaMg(CO3)2 + 4SiO2 + H2O → Mg3Si4O10(OH)2 + 3CaCO3 + 3CO2
회백색 진주색의 광택을 가진 암석이다. 미세한 얇은 편상의 결정이 모인 집합체며, 결정이 모여서 굳은 모양을 나타내는 경우가 많고, 큰 단결정 상태로 생산되는 경우는 드물다.
활석은 모스 경도 1의 기준이 되는 표준물질로서, 광물 중 가장 부드러운 것 중 하나이다. 손톱으로 긁힐 정도이다.(손톱의 경도는 2.5도). 순수한 것은 안정적인 경도를 나타내지만 불순물이 포함된 경우 경도가 높아진다.
분말로 하여 칠판 분필, 완구, 공사 현장 등에서 마킹용, 베이비파우더 같은 화장품 류, 의약품과 고급용지 첨가제 등에 쓰인다.
품질이 낮은 것은 석면을 함유하는 경우가 있으므로 실수로 흡입하거나 하지 않도록 주의가 필요하다. 이뇨 작용, 소염 작용이 있다고 한다, 저령탕(猪苓湯), 방풍통성산(防風通聖散) 등의 한방약에도 배합된다. 해외에서는 악성 흉수(胸水 늑막염) 환자에 대한 흉막유착술에 이용된다. 일본에서도 의약품으로 승인을 목표로 의사 주도의 임상실험이 이루어지고 있다.
. 활석 (암석)활석은 휘석, 각섬석, 감람석 등 마그네슘 규산염을 주성분으로 하는 광물에서 만들어진 암석이 열수(熱水) 변성하여 발생된 변성암이고, 전술한 무기물이 주성분을 이루고 다른 무기물이 일부 혼합된 상태에서 생산되는 것이 많다.
□ 규산칼륨 K2SiO3
규산칼륨(potassium silicate, K2SiO3), 분자량 154.28 g mol−1, 물유리 상(状)의 물질로 건축, 용접, 세제 등에 이용된다.
. 제법 및 용도
수산화 칼륨과 규산 젤을 원료로 한 습식 방법과 건식 법이 있다.
용도는 건설산업 (45%), 용접봉 (19%), 세제 (16%) 순이며, 비료로도 쓰인다. 금속의 산화방지를 목적으로 하는 용접봉 피복재, 무기질 도료의 경화제, 액체 세제 및 칼리 비누 원료로 사용된다.
□ 규산에틸 Si(OC2H5)
오루토규산 테트라에틸 (Si(OC2H5), Tetraethyl orthosilicate, 규산에틸, TEOS)은 분자 중심의 SiO4 4- 이온 (오루토규산 이온)에 에틸기 4개가 연결된 구조이다. 용액 중의 이온으로 오루토규산 이온은 존재하지 않으며, TEOS는 오루토규산 (Si(OH)4) 에틸에스테르 라고 해석할 수 있다.
TEOS는 정사면체 구조를 취한다. 여러 가지 알코올류가 존재하며, 대부분은 사염화규소를 알코올 용매의 분해에 의해 합성된다. 메틸, 에틸기 등의 알킬기를 R이라고 할 때,
SiCl4 + 4 ROH → Si(OR)4 + 4 HCl
. 이용 TEOS는 주로 실리콘 수지의 가교제로 사용되고 있다. 또한, 카펫 등의 코팅제나 에어로젤 등을 만드는데도 사용된다. 이 용도는 Si-OR 결합의 반응성을 이용하고 있다.
물과 반응하여 쉽게 이산화규소로 변화시킬 수 있다.
Si(OC2H5)4 + 2 H2O → SiO2 + 4 C2H5OH
이 가수분해 반응은 졸겔법의 일례이기도 한데, 에탄올이 부생성물로 나온다. 이 반응은 광물과 같이 Si-O-Si 결합을 갖는 고체에도 TEOS 분자가 변화하며, 침전하는 형태로 진행해 간다. 반응속도는 촉매로 작동하는 산과 염기의 존재에 의해 크게 달라진다.
600 ℃ 이상의 고온에서 TEOS는 디에틸에테르를 생성하고 이산화규소로 변한다.
Si(OC2H5)4 → SiO2 + 2O(C2H5)2
□ 규산메틸 Si(OCH3)4
오르토규산 테트라메틸, 별칭 규산메틸, TMOS, SiC4H12O4, 분자량 152.25
무색 투명의 액체, 밀도 1.032, 융점 4-5 °C, 비점 121–122 °C, 유독성
오루토규산 테트라메틸(Si(OCH3)4, Tetramethyl orthosilicate, 규산메틸, TMOS), 분자량 152.25, 무색 투명의 액체, 밀도 1.032, 융점 4-5 °C, 비점 121–122 °C, 유독성
이 분자는 SiO4 4- 이온 (오루토규산 이온)에 4개의 메틸 그룹을 붙인 것과 같은 구조를 하고 있다. TEOS와 기본적인 성격이 유사하고, 가수분해시 TMOS에서 발생하는 메탄올은 TEOS가 내는 에탄올보다 독성이 높기 때문에 TMOS보다는 TEOS를 더 많이 이용한다.
TMOS는 물과 반응하여 불용성의 SiO2 (이산화규소)를 생성한다. 눈에 들어가면 시력이 손상될 위험이 있다.
Si(OCH3)4 + 2 H2O → SiO2 + 4 CH3OH
TMOS는 졸겔법 실리카겔의 제조에 쓰인다. 유기합성화학에서는 케톤이나 알데히드를 아세탈로 변화시킬 때 사용 해왔다.
□ 질화규산 Si3N4
질화규소(silicon nitride), N4Si3, 분자량 140.28 g/mol, 밀도 3.44 g/cm3, 융점 1900 ℃ 분해, 회색 분말, 결정구조 6방정계(六方晶系)
결정구조는 육방정계(六方晶系)로 α-Si3N4와 β-Si3N4가 있다. 질화실리콘(Si3N4)의 종류로는 (1) sintered silicon nitride (SSN) 소결 질화규소 (2) gas pressure sintered silicon nitride (GPSSN) 가스 압력소결 질화규소 (3) hot-pressed silicon nitride (HPSN) 열처리 프레스가공 질화규소
. 용도
매우 높은 경도 등의 우수한 기계적 특성을 갖기 때문에 베어링, 터빈, 절삭공구 등에 응용되고 있다.
□ 탄화규소 SiC
탄화규소 SiC, 분자량 40.097 g/mol, 밀도 3.22 g/cm3, 융점 2730 ℃
탄화규소 (Silicon Carbide, SiC)는 탄소(C)와 실리콘 (Si)이 1대 1인 화합물이다. 천연에는 운석(隕石) 중에 약간씩 존재한다. 광물학 상으로는 "moissanite"라고 하며, 19 세기 후반에 공업화한 회사 상품명인 "카보란담"이라고 불리기도 한다.
다이아몬드 사촌, 또는 다이아몬드와 실리콘의 중간적인 성격이 있고, 경도, 내열성, 화학적 안정성이 뛰어나기 때문에 연마재, 내화물, 발열체 등에 사용되고, 반도체나 전자소자의 소재로도 된다. 크리스탈의 광택을 가진 흑색이나 녹색 분립체로 상품화 된다.
Si와 C는 모두 주기율표에서 같은 IV 족에 속하는 원소로서, 기본적으로 공유결합성이 있다, 전기 음성도의 차이에 의한 이온성을 가지고 있기 때문에 1 대 1 정비율 화합물로서 안정적으로 존재한다.
탄화규소는 수십가지 종류의 결정구조가 알려져 있다. (2H六方晶11, 3C, 4H, .. 15R 형 등)
. 공업적 제법
SiO2 + 3C → SiC + 2CO
전기로에서 전극에 전압을 가하면 흑연 가루가 발열하여 주위의 재료를 가열한다. 1500 ℃를 넘으면 미세한 3C가 발생하기 시작하고, 온도가 올라감에 따라 3C는 사라지게 되고 4H, 6H, 15R 형 등의 결정구조로 발달하지만, 2200 ℃ 이상이 되면 그들은 분해하여 흑연 분말이 된다.
전력을 차단하고 보면, 동심원 중심부의 흑연분말은 SiC로 분해된 만큼의 중량이고 나머지만큼은 (사선으로 발생) SiC 괴(塊)가 생성된다. 그 외측은 온도가 1500 ℃ 정도 밖에 오르지 않아, 얇은 층의 3C가 보이고, 아래와 외부는 반응하지 않는다.
미반응물은 다음 번 운전시 원재료에 섞는다. SiC 괴는 중심에서 바깥쪽으로 放射状으로 발달한 결정입자로서 통기성이 좋다.
생산 공정은 “원재료 및 흑연 분말을 쌓기 → 통전 → 단전 및 냉각 → SiC괴(塊) 취출” 등이며, 각각 공정의 길이는 몇 일씩 된다. 그 후의 공정으로는 “ → 불순물 분리 → 분쇄 → 입도 분리 → 완성제품” 이 있다.
이 탄화규소 생산에는 다량의 전력이 필요하므로 값싼 전력을 얻을 수 있는 곳이 유리하다.
. 성질
주기율표 IV족인 C 와 Si는 탄소 원자보다 실리콘 원자가 더 크기 때문에, C <SiC <Si 순으로 원자간 거리가 커진다. 그리고 열전도율은 작아지며, 경도는 낮아진다.
탄화규소의 특장점은 경도로서, 활석 1, 다이아몬드 15로 볼 때, 수정 모스경도 등급은 13이다.
순수한 탄화규소는 무색투명 하지만, 공업제품은 녹색에서 검은색을 띠게 되므로 제조환경을 깨끗이 하여 색상을 최대한 엷게 하려고 한다. 착색은 질소, 알루미늄 등 III 족 V 족 원소의 원자가 결정격자에 끼어들어 되는 불순물 때문이다.
따라서 결정의 전기저항은 색깔이 엷을수록 대폭 높아져, 발열체의 원료로는 녹색제품이 사용된다.
탄화규소는 800 ℃ 이상의 대기 중에서 산화하지만, 표면에 생성되는 SiO2가 산화를 늦추게 하는 보호 피막이 된다. 3070 ℃에서 기화한다고 한다.
불화 수소, 황산, 질산의 혼합액에 약간 녹으며, 일부 종류의 용융염이나 융철에는 녹는다.
. 용도
연마재, 내화벽돌의 원료, 주철의 탄소 또는 규소 첨가제, 실리콘 접착제 등에 많이 사용된다. 주철용은 저순도 제품이 사용된다.
전기소자(電気素子)의 소재로서는, 발열체, 어레스터, 바리스터 등에 오랫동안 사용되어 왔다. 실리콘보다 밴드갭이 커서, 고온, 고선량(高線量)에도 사용할 수 있는 반도체 재료로 주목받아, 1980 년대 이후 결정성장 기술의 발전에 따라 청색 발광 다이오드, 고속 쇼트키배리어다이오드, MOSFET (전계효과 트랜지스터) 등에 쓰이게 되었다. 열전도율이 높기 때문에 다른 반도체의 기판으로서도 유용하다.
파인세라믹스, 엔지니어링세라믹스 로서의 용도도 커지고 있다. 금형프레스 성형, 유압 성형, 사출 성형, 슬립캐스팅 성형, 압출성형 등 성형법과 반응소결(焼結), 상압소결, 가압소결, 재소결 등의 소결법에 사용되고 있다.
최근 디젤자동차에서 배출하는 매연의 집진용 필터 (DPF) 재료로서의 용도도 급속히 확대되고 있다.
또한 굵은 것은 장식용 보석으로서도 쓰이는데, "모앗사나이트 다이야몬드"라고 하여 다이어몬드의 일종인 것처럼 속여서 고액에 거래하는 경우도 있다고 한다.
(참고자료)
. SiC on Physical Properties of Semiconductors
자료 : http://www.ioffe.ru/SVA/NSM/Semicond/SiC/index.html
![]() Basic Parameters at 300 K
Basic Parameters at 300 K![]() Band structure and carrier concentration
Band structure and carrier concentration
![]() Basic Parameters
Basic Parameters
![]() Band Structure
Band Structure
![]()
Intrinsic carrier concentration
![]() Effective Density of States in the Conduction and Valence Band
Effective Density of States in the Conduction and Valence Band
![]()
Temperature Dependences
![]() Dependence on Hydrostatic Pressure
Dependence on Hydrostatic Pressure
![]()
Energy Gap Narrowing at High Doping Levels
![]() Effective Masses and Density of States
Effective Masses and Density of States
![]() Donors and Acceptors
Donors and Acceptors![]() Electrical Properties
Electrical Properties
![]() Basic Parameters of Electrical Properties
Basic Parameters of Electrical Properties
![]() Mobility and Hall Effect
Mobility and Hall Effect
![]() Transport Properties in High Electric Fields.
Transport Properties in High Electric Fields.
![]() Impact Ionization.
Impact Ionization.
![]() Recombination Parameters.
Recombination Parameters.![]() Optical properties
Optical properties![]() Thermal properties
Thermal properties
![]() Basic parameters
Basic parameters
![]() Thermal conductivity
Thermal conductivity
![]() Lattice properties
Lattice properties![]() Mechanical properties, elastic constants, lattice vibrations
Mechanical properties, elastic constants, lattice vibrations
![]() Basic Parameters
Basic Parameters
![]() Elastic Constants
Elastic Constants
![]() Acoustic Wave Speeds
Acoustic Wave Speeds
![]() Phonon Frequencies
Phonon Frequencies
![]() Piezoelectric, Thermoelectic and Magnetic Properties
Piezoelectric, Thermoelectic and Magnetic Properties![]() Impurities and defects.
Impurities and defects.![]() References
References
□ 사염화규소 SiCl4
염화규소 (silicon chloride)는 4염화물 6염화물 등 여러 가지 조성이 있다. 물과 반응하여 염화수소를 생성한다. 사염화규소와 6염화-2규소는 유기규소 화합물의 제조에 매우 중요하다.
사염화규소(Silicon tetrachloride, SiCl4)는 무색의 자극적 냄새가 있는 액체이다.
융점 -70 ℃, 끓는점 57.6 ℃, 규소와 염소 또는 염화수소를 가열하거나 규화칼슘 등을 염소화 하여 제조된다. 고순도 금속 규소의 제조에도 사용된다. 제조 시 폐기물로 배출될 수 있어 환경 문제가 되고 있다.
. 6염화2규소 (Hexachlorodisilane, Si2Cl6)는 무색의 자극적 냄새가 있는 액체이다.
녹는점은 -1 ℃, 끓는점은 144 ℃로서, 사염화규소 보다 높은 편이며, 300 ℃ 이상에서는 염소와 반응한다.
Si2Cl6 + Cl2 → 2SiCl4
. 기타 규소의 염화물 :
SiCl3, Si3Cl8, Si4Cl10, Si5Cl12, Si6Cl12
□ 실란 SiH4
실란 (silane, 수소화규소, SiH4)은 분자량 32.12의 무기 화합물이다. 특이한 냄새가 있는 무색의 기체이며, 액화 가스로도 얻을 수 있다.
무색 기체, 상대증기밀도 1.1(공기 1) 융점 −185 °C, 비점 −112 °C
규소 수 2, 3의 고급 수소화물은 각각 디-실란, 트리-실란이라고 불리고, 그것과 구분 지워 SiH4는 모노실란이라고도 한다. 공기 중의 산소에 의해 신속하게 산화되어 물과 이산화규소로 분해 되고, 실란의 농도가 높으면 불이 없어도 자연발화 되어 연소한다.
실란 유도체의 실리콘 분자 궤도는 sp3 혼성 궤도로서, 수소원자가 규소를 중심으로 한 정사면체의 각 정점에 위치하고 있다. 극성이 작은 hexane, 에테르 등의 유기용매에 잘 녹는다. 알콜류와는 서서히 반응한다. 가장 간단한 기체 형태의 규소 화합물이며, 반도체 제조에 사용되는 대표적인 특수재료이다.
. 폴리실란 일반 표현식 SinH2n+2 (n>2)의 화합물의 총칭이다. 규소 수가 정해진 올리고실란이라 불리는 것도 있다. 성질은 규소를 탄소로 치환한 알칸과는 달리, 낮은 최저 천이(遷移) 에너지를 갖는 등의 재미있는 성질을 보인다. 일반적으로 규소-규소 결합을 구축하는 반응으로는 할로실란의 알칼리 금속에 의해 우루츠형 커플링(Wurtz-Fittig reaction)만 이용되기 때문에 알칸에 비해 화합물이 다채롭게 된다.
모체의 수소 치환체는 공기 중의 산소에 의해 폭발적으로 산화되고, 자발적인 연소를 동반하기 때문에 취급이 곤란하여 규소에 알킬 또는 알릴기를 두는 유도체 연구가 많이 수행된다. 특수 고압가스이다.
. 유기실란지금까지 많은 실란 유도체가 합성되었다. 메틸화 물질인 테트라메틸실란은 자기공명분광법에서 양성자, 탄소13, 규소29의 핵종(核種)의 표준물질로서 사용된다. 유기화학에서는 그 일반식이 RR1R2R3Si (각 치환기는 H 또는 유기 기(基))로 표시되는 유도체의 총칭을 일컬어 실란이라고 부르는 경우가 많다.
□ 실리콘 Silicone
입체구조 실리콘 (silicone)은 실록산 결합에 의한 주 골격을 갖는 인공 고분자화합물의 총칭이다. 어원은 실리코케톤 (silicoketone)으로, 케톤의 탄소원자를 규소원자로 치환한 화합물을 의미한다.
그러나 관용적인 저분자 실란 류를 포함한 유기규소 화합물 전반을 가리키는 의미로 사용되는 경우도 있다.
. 개요
화학적으로는 디메틸디클로로실란을 시작으로 하는 각종 실란류를 가수분해하여 생성된 실란류 (R3Si-OH)가 탈수축합된 올리고머나 폴리머이다. 모노머가 10 (또는 20) 이하의 비교적 저분자의 것은 폴리실록산 (polysiloxane) 또는 단순히 실록산이라고 불린다.
또한, 고분자인 합성수지로서 사용되는 것들은 일반적으로 "실리콘 수지"혹은 생략되어 "실리콘"이라고 부르는 경우가 많으므로, 원소나 단체(単体)의 규소(silicon)와 오해의 소지가 있으니 주의해야만 한다.
. 구조
주골격인 실록산 결합 (Si-O-Si)은 일반적으로 유기물의 골격을 형성하고 있는 탄소-탄소 결합에 대해 결합 에너지, 원자간 거리, 결합각 등이 모두 크고, 분자 전체가 나선 구조 을 취하고 있다. 이러한 특성에 의해 통상의 유기물에는 볼 수 없는 다양한 특징들을 갖고 있다.
주골격 결합이 강해서 가장 기본적인 특징인 내열성을 발휘하여, 200 ℃ 이상 (구조나 조건에 따라서는 400 ℃)의 고온에도 견딘다. 또한 고온에서는 점차적으로 변성 (산소에 의한 탈수중합에서 고분자화)과 분해 (환상 실록산의 생성에 의한 저분자화)하지만, 그 속도는 완만하여 연소나 폭발을 수반하지 않는다. 또한 분해 생성물은 주로 실리카와 이산화탄소로서 위험성이 낮다.
화학적으로 안정하여 산화. 분해되기 어려운 성질은 실험실에서 플랜트에 이르는 화학분야에서 유용하고도 필수적인 것이 되며, 생리활성이 낮기 때문에 인간을 포함한 생체에의 독성이 작은 요인 된다 (참고로 체내에 침투하면 이물성 육아종(異物性肉芽腫) 등의 활성이 낮은 물질로 되는 반응도 있다.)
실록산 결합의 밴드갭이 크기 때문에 전기절연성이 비교적 높다. 그만큼 유전율이 작기 때문에 전기장을 방해하지 않고, 발열이 낮은 (마이크로파의 가열을 받지 않는) 내열성과 같은 요인으로 절연 내력(耐力)이 우수하고, 자외선이나 방사선에 의한 공격에도 어느 정도 견디므로 내후성(耐候性)도 있는 편이다.
나선형의 분자구조는 내측의 주골격 (무기성)을 치환기 (유기성)가 둘러싼 구조로 되어 있다. 따라서 폴리실록산에서 보이는 수소결합이 방해 받아, 분자간력(分子間力)이 상대적으로 작다. 이 성질은 액체에서 표면장력이나 온도에 따른 점성 변화를 작게 하고 고체에서는 발수성이나, 가스 투과성을 높게 만든다.
. 치환기 또한, 규소 상에 유기성의 치환기를 다수 가지고 있기 때문에 유리 등의 무기 화합물에는 없는 계면특성을 가질 수 있다. 도입되는 치환기를 선택하고 또한 골격을 환상이나 분기구조로하므로서 내열성이나 내화학성, 친수성(親水性)이나 소수성(疎水性) 등 여러가지 기능이 강화되거나 부가될 수 있다
사용되는 치환기로서는, 폴리에테르, 에폭시, 아민류, 카르복실기, 알킬기 등 다양하고, 도입위치 (측쇄, 말단)의 조합 등에 따라 매우 방대하게 갈라지는데, 메틸기 또는 페닐기만을 도입 한 직선 실리콘 대해 변성 실리콘이라고 불린다.
페닐 기의 양을 증가하면 저온에서 경화가 어려워져 내한성이 증가하고,
불소를 포함한 플루오르알킬기를 도입하면 내유성(耐油性)이나 소수성(疎水性)이 향상된다.
아미노기를 소량 도입하면 에멀젼 특성이 크게 개선된다,
폴리에테르기는 윤활성 개선에 효과가 있다.
. 제조
대부분 대기업은 원료 실란에서 일관생산 한다.
금속 규소(비교적 저순도의 것)와 염화메틸을 구리 촉매 존재 하에서 300 ℃ 전후로 가열하면 디메틸클로로실란을 주체로 하는 실란 류를 생성한다. 염화메틸 이외에도 목적으로 하는 유기기(有機基)나 골격구조에 따라 각종 유기염소 화합물이 사용된다. 예를 들면, 페닐기의 도입에 필요한 페닐실란은 클로로벤젠이 이용된다. 그러나 어느 경우에도 부생성물이 많기 때문에 정류공정(精留工程)이 필수적이다. 분리된 부생성물은 재반응하여 실란으로 이용된다.
이어서 가수분해와 탈수.축합 공정을 거치는데, 염화실란 류는 가수 분해에 의해 염산을 만들어 내고 이것이 산 촉매로서 작용하기 때문에 생성된 실란올은 그대로 자기축합(自己縮合)하여 실록산이 된다. 따라서, 제조하고자 하는 실리콘에 따라 실란 류의 배합 비율과 부 원료, 반응 온도 등의 조절이 중요하다.
제조 공정에서 정류공정(精留工程)을 거치므로서, 실란 류의 순도가 높아지고, 제품 성능도 높이는 요인이 되지만, 가수분해와 탈수축합을 동시에 진행하기 위해 제품 중에 환상 실록산 등의 저분자 성분이 일부 생성된다. 용도에 따라 장애의 원인이 되기 때문에 함유량을 감소시키기 위한 방법들이 개발되고 있다.
. 역사
실리콘이 처음 합성된 것은 20 세기 초 영국 Frederic Stanley Kipping에 의해 보고 되었다. 곧 그 뛰어난 성질이 알려지게 되었지만, 수익성 등의 측면에서 실험수준에 머물고 있었다. 그런 다음 응용 연구가 미국에서 진행되면서, 1940 년 GE 사의 Eugene G. Rochow에 의해 직접법 개발을 계기로 내열 절연체로서 군수산업에 이용이 확대되었다. (B29에도 사용되었다)
일본에서는 도쿄 시바우라 전기가 1941 년에 실리콘 수지의 연구에 착수하여 1951 년부터 자사 제품에 사용하고 있다. 실리콘 소재로의 판매는 1953 년 신에츠(信越化学工業)에서 했다.
. 시장 규모북미, EU, 동아시아를 중심으로, 2000 년 현재 약 70 억 달러로 추정되며, 생산.소비도 확대 추세이다. 주요 제조업체로는 다우코닝 (Dow Chemical과 코닝 합작사), 제너럴 일렉트릭, 신에츠(信越化学工業), Wacker Chemical (독일), 로디아 (프랑스). 도레이, 아사히 화성 등
. 용도일반적으로 무색 무취 발수성 있고 탄소 골격의 폴리머에 비해 내유성 내산화성 내열성이 높고 不導体이기 때문에 중합도나 치환기 등이 다른 다양한 형태의 제품이 생산된다.
그러나 금속산화물(염기)의 성질을 가지므로 강산에는 약하고 변질(백화, brittle 화)하게 된다. 또한, 프레온, 대체 프레온, 톨루엔, 아세톤, 메틸 에틸 케톤 등 일부 용매에 침해 된다. 따라서 이런 환경에 노출되는 경우에는 사용되지 않는다.
. 오일실록산 결합이 2000 이하 직쇄 구조의 분자는 오일 성질을 많이 보이기 때문에, 각종 기제(基剤)와 혼합하여 사용된다.
. 실리콘 오일 : 표면 장력이 작고 불연성 오일로 분자량 차이 등에 따라 다양한 점도로 제조된다.
. 윤활제 : 광유계(鉱油系)를 적용할 수 없거나, 저온 고온, 용제의 존재 시, 내유성이 떨어지는 재질 등의 윤활에 사용된다. . 오일콤파운드 : 실리카와 알루미나 미분말(微粉末)을 배합하여 높은 열전도성을 제공하여 CPU의 방열, 전기용 광학 등.
. 소포제 : 표면장력이 작고 소수성 특성으로, 에멀젼 형태로 식품산업을 비롯한 각종 용액처리 공정에 사용
. 화장품 : 저분자, 특히 환상(環状)분자의 휘발성을 이용하여, 퍼짐이 좋고 끈적거리지 않으며, 촉감개선을 위한 분산제로 사용된다.
. 일용품 : 섬유 표면에 잘 적응되고, 마찰계수를 작게 하는 기능이 있어 티슈, 린스, 유연 마무리제 등에
배합된다.
. 고무 : 실록산 결합이 5000 ~ 10000 직쇄(直鎖)구조 분자는 고무성질을 가지는데, 주로 이차의 가황공정을 거쳐 이용된다.
. 고무컴파운도 : 성형품으로서 각종 씰링제나 다이아프람, 보호용 부품 등에 널리 사용된다. 정확하게
고무라기 보다는 탄성체라고 부른다. 뛰어난 내구성 외에도 열수축성과 방열성을 강화한 것 등 폭 넓다.
. RTV 고무 : 상온 경화형 고무로 일반적으로 액체상태로 시판되고 있으며, 촉매를 첨가하면 실리콘 중합반응이 되면서 경화한다. 일액형과 이액형이 있는데 차후 반응유형에 따라 부가반응형과 축합반응형으로 구분된다. 밀착성이 좋은 보호재료나 방열재료, 또는 중고장비나 치과의료 등의 형틀제 등 용도가 넓다.
. 의료 소재 : 탄성재료나 섬유재료로서 이용되고 있으며, 전자는 버룬카테테르(Baloon-catheter),
후자는 기체 투과성이 양호하여 인공심장막 등으로 이용되고 있다.
. 실리콘하이드로겔 : 친수성 젤 실리콘을 배합한 것으로, 산소 투과형 렌즈와 성형외과 성형수술 필러 등에
도 이용되고 있다.
. 실리콘 수지 : 규소수지로서, 실록산 골격을 분지(分枝)구조로 하고, 여기에 치환기로서 메틸기, 페닐기 등 을 달고 있다. . 왁스 : 직쇄(直鎖)올레핀을 달고 있는 분자량 1000 이하의 분자는 밀랍 상(状)이며 자동차 왁스 등에 사용
. 의약품 : 디메틸폴리실록산이 소화기 내의 가스 제거제로 사용된다.
(참고자료)
. Si Semiconductor
(자료): http://www.ioffe.rssi.ru/SVA/NSM/Semicond/index.html
http://www.ioffe.ru/SVA/NSM/Semicond/Si/index.html![]() Basic Parameters at 300 K
Basic Parameters at 300 K![]() Band structure and carrier concentration
Band structure and carrier concentration
![]() Basic Parameters of Band Structure and carrier concentration
Basic Parameters of Band Structure and carrier concentration
![]() Temperature Dependences
Temperature Dependences
![]() Energy Gap Narrowing at High Doping Levels
Energy Gap Narrowing at High Doping Levels
![]() Effective Masses and Density of States
Effective Masses and Density of States
![]() Donors and Acceptors
Donors and Acceptors![]() Electrical Properties
Electrical Properties
![]() Basic Parameters of Electrical Properties
Basic Parameters of Electrical Properties
![]() Mobility and Hall Effect
Mobility and Hall Effect
![]() Transport Properties in High Electric Fields
Transport Properties in High Electric Fields
![]() Impact Ionization
Impact Ionization
![]() Recombination Parameters
Recombination Parameters![]() Optical properties
Optical properties![]() Thermal properties
Thermal properties![]() Mechanical properties, elastic constants, lattice vibrations
Mechanical properties, elastic constants, lattice vibrations
![]() Basic Parameters
Basic Parameters
![]() Elastic Constants
Elastic Constants
![]() Acoustic Wave Speeds
Acoustic Wave Speeds
![]() Phonon Frequencies
Phonon Frequencies![]() References
References
(참고자료)
. n,k Database, Silicon & Silicide
Data 보기 : http://www.ioffe.ru/SVA/NSM/nk/index.html
. Silicon 목록 . Silicide 목록
□ 환상(環状)실록산 Cyclic siloxanes
환상(環状)실록산 (Cyclic siloxanes, Cyclosiloxanes)은 실록산 결합에 의해 환상(環状)분자구조 골격을 가진 유기 화합물의 총칭.
. 개요대다수가 올리고머이며, 특히 저분자의 것은 환상(環状) 디메틸형(D 형, 분자식 SiO(CH3)2)의 결합량에 따라 D3 (3량체), D4 (4량체), D5 (5량체) 등으로 표기된다.
D3 : hexamethyl cyclotrisiloxane, C6H18O3Si3 녹는점 64 ℃, 비등점 134 ℃의 고체 D4 : octamethyl cyclotetrasiloxane, C8H24O4Si4 녹는점 18 ℃, 비등점 175 ℃의 semisolid D5 : decamethyl cyclopentasiloxane, C10H30O5Si5 녹는점 -30 ℃, 끓는점 210 ℃의 액체D20까지 저분자 환상실록산이라 하며, 특히 D3 ~ D10의 총량은 접점 저해 등을 방지하는데 대한실리콘 품질기준의 지표가된다.
. 용도
주로 실리콘 제조의 원재료로 사용되며, D5는 용제로서 용도가 넓다.
드라이 클리닝 솔벤트 : D5는 상온에서 액체로 휘발성이 있고, 환경 중에 방출해도 단기간에 이산화규소, 이산화탄소, 물로 분해되므로 환경에 미치는 영향이 경미하여 사용되고 있다. 이 방법은 영어로 GreenEarth Cleaning이라 불리는 특허가 되어있다.
화장품 : 시쿠로펜타실록산 이라고 표기된다. 독성이 낮은 용제로서, 빼기 어려움을 특징으로 하는 제품에 널리 사용된다.
기타 의약품을 포함하여 피부 세정제, 모발 염색제에 유화제로서 사용된다.
. 문제점
저분 환상실록산은 고비점 물질이지만 휘발성이 높기 때문에 실온이나 체온 부근에서도 증기로 되어 공기 중에 확산된다. 이런 성질 때문에 여러 가지 문제점이 나온다. 용제로 사용하는 현장 이외에서 발생하는 원인으로서, 실링.코킹재 등의 실리콘 수지 제품이나 샴푸, 화장품 등에 포함된 실리콘 오일을 생각할 수 있다.
전기 전자 회로에 장애
증기가 전기회로 및 릴레이 접점 등의 표면에서 전류에 의한 발열로 분해되면 절연성의 실리카 석출하고 접점 불량이 발생한다. 고농도로 사용하는 크리닝 공장이나 실리콘 그리스를 사용하는 자동차의 전자제품 등에서 오작동이나 고장을 초래한 경우가 있다.
반도체 생산 라인에의 영향
제조중인 실리콘 웨이퍼에 부착하면 반도체 특성을 바꾸어 버려, 저농도로도 제품 수율을 저하시킬 우려가있다. 따라서 공장의 클린룸 건설에 사용되는 실리콘 제품에는 특히 실록산의 저감이 요구된다.
바이오 가스 이용설비에의 장애
하수 슬러지의 혐기성소화(嫌気性消化)에 의해 메탄가스를 생산할 때, 슬러지 속에 포함되어있던 실록산이 혼입한다. 이것이 연소시 분해하여 생성된 실리카가 가스터빈의 내부나 보일러 버너 및 열교환기 굴뚝에 석출, 퇴적하여 효율 저하나 장애를 일으킨다. 흡착 및 세척에 의한 제거기술이 실용화되고 있지만 바이오가스 이용의 원가상승 요인으로 된다. 이 외에도 연료전지의 격막을 손상할 우려도 있다.
□ 유기규소 화합물
유기규소화합물은 탄소-규소 결합을 갖는 유기화합물의 총칭이다. 탄소와 마찬가지로 유기규소 화합물 중의 규소원자도 4가로서 사면체형 구조를 취한다. 최초의 유기규소화합물인 테트라에틸실란은 1863 년 Charles Friedel과 James Mason Crafts 등에 의해 사염화규소와 디에틸아연의 반응으로 합성되었다.
SiCl4 + 2 Zn(C2H5)2 → Si(C2H5)4 + 2 ZnCl2
탄소와 규소를 포함한 가장 간단한 화합물은 탄화규소로서 1893 년에 발견된 이후 많은 공업적인 용도가 알려지게 되었다.
규소를 시작으로 한 규산염을 이용하는 생물은 다수 볼 수 있으며, 식물에도 규소가 여러 가지 유리한 작용이 있는 등, 생물에게 있어서 규소는 밀접한 관계가 있다. 또한 규소는 유기화합물을 구성하는 탄소와 동족 원소이기 때문에 규소를 주요 구성요소로 하는 생물 (규소생물)이 자주 SF 작품에 나타난다. 그러나 지금까지 생체물질 중 유기규소화합물 자체를 보인 사례는 없는 것으로 안다.
. 유기실란
탄소-규소 결합은 탄소-탄소 결합에 비해 길고 (각각 184 pm 154 pm), 해리 에너지도 작다. (각각 451 kJ/mol, 607 kJ/mol) 전기음성도의 차 때문에 (C, 2.55 ; Si, 1.90) C-Si 결합은 극성이 다소 치우쳐있어, 탄소가 음전하를 띤다. 테트라메틸실란 등을 포함하는 실란류의 화학적 성질은 열적 안정성 등의 점들이 알칸과 유사하다.
β-규소 효과는 β위(位)의 규소원자가 카르보카티온을 안정시켜 그 반응성에 영향을 미치는 효과인 것이다.
. 실옥시드규소와 산소의 결합 거리는 C-O 결합에 비해 매우 짧고 또한 강하다.(각각 809 kJ/mol, 538 kJ/mol). 극성은 산소 원자로 몰려있다. 예로 실록산이나 그 중합체인 폴리실록산을 들 수 있다. 또한 시릴 에테르는 알코올의 보호기로 널리 사용된다. Si-O 결합보다 강한 것은 규소-불소 결합뿐이기 때문에 탈보호(脱保護)에는 불소를 포함한 화합물 (불화 Tetra-n-부틸암모늄 (TBAF), TASF, TBAT 등)이 효과적이다. Si-O 결합의 생성 용이성을 이용한 화학반응은 여러 가지가 있다. 브루크 전이, 피터슨 반응 등이 알려져 있다.
. 시릴하이드리드
규소-수소 결합은 C-H 결합보다 길고(각각 148 pm 105 pm) 약하다.(각각 299 kJ/mol 338 kJ/mol). 음전하를 띠는 것은 수소원자 쪽이기 때문에 규소화수소가 아니라 시릴하이드리드 (수소화규소)로 불린다. 시릴하이드리드는 반응성이 매우 높고, 폴리 (메틸하이드리드실록산) (PMHS) 등은 환원제로서 사용된다.
. 실렌
탄소의 유도체와 달리 이중결합을 포함하는 유기규소화합물은 그다지 알려져 있지 않다. 이것은 Si=C 결합이 높은 반응성을 갖기 때문이고, 그 결과 올리고머화, 물, 산소와 쉽게 반응한다. Si=C 결합을 가진 화합물로서 벤젠의 규소류 연결체인 시라벤젠, Si=Si 결합을 갖는 화합물로서 디실렌 등이 연구대상이 되고 있다.
또한, 규소-규소 삼중결합 (Si≡Si)을 포함한 유기규소화합물이 2004 년 츠쿠바 대학의 関口章에 의해 합성되었다. 그 중심의 Si-Si≡Si-Si 구조에서 아세틸렌의 경우와는 달리 Si-Si≡Si 결합각이 137 °로 구부러져 있다.
□ 트리메틸규소
trimethylsilyl group은 유기화학에 있어서 3 개의 메틸기가 규소에 연결된 구조를 갖는 1 가의 치환기 (-Si(CH3)3)가 있는 것이다. 유기합성에서 보호기(保護基)로서 사용된다. 약칭 TMS로 표시된다. 천연 화합물에서는 발견되지 않는다.
. 이용
알코올이나 페놀류, 카르본산 등 hydroxy기를 위하여 휘발성이 낮은 화합물에 트리메틸실릴기를 도입하면 그 휘발성을 강화할 수 있다. hydroxy 기 (-OH)에 대해 적절한 트리메틸시릴화 제재를 작용시켜 수소를 치환하고, 트리메틸시록시 (-OSi(CH3)3)로 한다. 이 때의 생성물은 트리메틸시릴에테르이다.
R−OH + TMS−X + Base → R−O−TMS + Base . HX
그러면 관능기의 극성이 내려가므로 휘발성이 높아 가스크로마토그래피나 질량분석법에의 적용이 용이하게 된다.
유기합성에서는 트리메틸시릴 기를 보호기(保護基)로서 사용한다. hydroxy기를 가진 화합물에 어떤 반응을 실시하려고 하는데, 그 반응에서 Hydroxy 기가 존재하여 부반응이 일어날 것이라는 경우라고 하면, 일시적으로 hydroxy기 상에 트리메틸시릴기를 도입하고 트리메틸시록시 기의 형태로 하면 그 부작용을 피할 수있다. 그 외에도 –SH, -C≡CH 등의 보호기로도 사용된다.
. 트리메틸시릴 化
알코올의 hydroxy기를 트리메틸시릴 기에서 보호하기 위한 시약의 조합은 다양한 상황에 맞는 방안들이 있다. 대표적인 예로, 클로로트리메틸실란과 트리에틸아민을 채택하는 방법을 든다.
R−OH + TMS−Cl + (CH3CH2)3N → R−O−TMS + (CH3CH2)3N. HCl
네이버에 ☞ http://blog.naver.com/tsc88/220285525328
■ 마노 (瑪瑙)
석영(石英, quartz, SiO₂)은 이산화규소(SiO₂)가 결정화한 광물을 말하며,
특히 무색 투명한 것을 수정(水晶, rock crystal)이라고 부른다.
석영 성분의 모래를 규사(珪砂)라고 부르며, 석영 성분의 광석을 규석(珪石)이라고 부른다.
마노(瑪瑙、agate)는 2가지 색 이상의 체크무늬를 띈 옥석의 일종이다.
마노는 광석의 모양이 말의 뇌를 닮았다고 하여 붙여진 이름이다.
Agate라는 영문 명칭은 이탈리아 시칠리아 섬의 강 이름인 Acate에서 유래했다고 한다.
옥수(玉髓, chalcedony)는 섬유상 은미정질(
隠微晶質) 석영 결정이 모여 있는 것으로
구상이나 종유상을 이룬다. 극히 미소한 공극이 많아 밀도가 낮다.
비중은 2.60~2.64.
콜로이드상 실리카가 별로 높지 않은 온도에서 결정되어 암석의 틈을 메운 상태로 산출된다.
깨끗한 적색 옥수를 카넬리언(Carnellian) 혹은 사드(Sard)라고 하고,
산화니켈에 의해 녹색을 띠는 종을 크리소프레이스(Chrysophrase)라고 한다.
프레이스(Prase)는 둔한 녹색을 띤다. 오닉스(Onyx)는 녹색과 흰색의 띠가 나란하게 배열된 것이고,
플라즈마(Plasma)는 밝은 녹색에서 에메랄드그린의 옥수로, 벽옥(자스퍼, Jasper)이 이에 속한다.
동심원상의 띠를 이루는 옥수를 마노(agate)라고 한다.
플린트(Flint)도 옥수의 한 종이다.